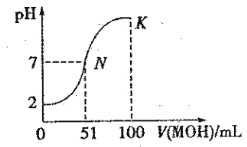
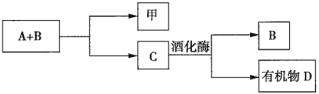
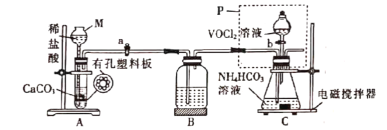
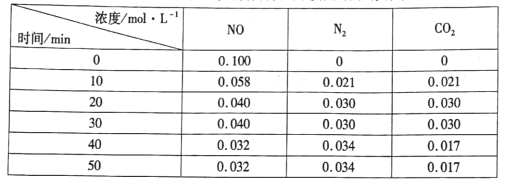
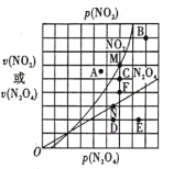
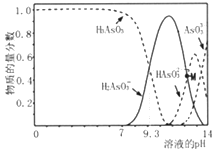
0 200724 200732 200738 200742 200748 200750 200754 200760 200762 200768 200774 200778 200780 200784 200790 200792 200798 200802 200804 200808 200810 200814 200816 200818 200819 200820 200822 200823 200824 200826 200828 200832 200834 200838 200840 200844 200850 200852 200858 200862 200864 200868 200874 200880 200882 200888 200892 200894 200900 200904 200910 200918 203614