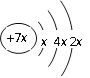题目内容
【题目】实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是____________(填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。
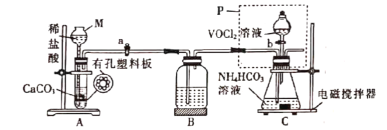
①仪器M的名称是___________,实验开始前的操作是_________。
②装置B的作用是__________________。
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用无水乙醇洗涤的目的是_______________。
④称量mg产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为VO2++Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________(填“偏高”、“偏低”或“无影响”),产品中钒的质量分数为_________(以VO2+的量进行计算,列出计算式)。
【答案】N2H4·2HCl 长颈漏斗 检查装置的气密性 除去二氧化碳气体中的氯化氢 除去晶体表面的水 偏高 ![]()
【解析】
根据合成氧钒(Ⅳ)碱式碳酸铵晶体流程,将V2O5通过盐酸、N2H4·2HCl的作用,还原为VOCl2,得到的VOCl2与碳酸氢铵溶液同时搅拌将得到氧钒(Ⅳ)碱式碳酸铵晶体;VOCl2转化为氧钒(Ⅳ)碱式碳酸铵晶体的过程如装置图所示,向反应体系中持续通入CO2,CO2溶于水生成碳酸,碳酸电离生成氢离子抑制了铵根离子的水解,保证氧钒(Ⅳ)碱式碳酸铵产率的最大化,反应完成后,将得到的晶体经洗涤、过滤、干燥得到较纯晶体,通过滴定的方法测定晶体中V的含量,据此分析。
(1)反应过程中稀盐酸起到酸性的作用,N2H4·2HCl在反应中起到还原剂的作用;
(2)①根据图示装置,仪器M为长颈漏斗;实验开始前要检查装置的气密性;
②装置B的作用是除去制备的二氧化碳气体中含有氯化氢气体,否则氯化氢与碳酸氢铵会发生反应,降低晶体产率;
③乙醇能与水互溶,利用乙醇具有挥发性可以除去晶体表面的水分;
④若(NH4)2Fe(SO4)2标准溶液部分变质,则还原能力降低,滴定时消耗的标准溶液的体积偏高,会使测定结果偏高;根据滴定反应VO2++Fe2++2H+=VO2++Fe3++H2O,钒元素的物质的量n=n[(NH4)2Fe(SO4)2]=cmol/L×V×10-3L=cV×10-3mol,产品中钒(以VO2+计)的质量分数为![]() 。
。