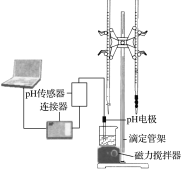
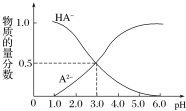
题目内容
【题目】新型钙钛矿型太阳能电池以其稳定、高效、便宜和便于制造等优点被科学家所青睐。这种钙钛矿型太阳能电池材料为层状结构。具体如图1所示。

(1)基态Ti原子的电子排布式为____;同周期的基态原子与其未成对电子数相同的元素还有________种。
(2)光敏钙钛矿的晶胞结构如图2所示。
①写出与CH3NH3+互为等电子体的一种分子的化学式:__,C、N、O三种元素的第一电离能由大到小的顺序为____(用元素符号表示),CH3NH3+中含有的化学键类型有____。
②光敏钙钛矿的化学式为________;每个CH3NH3+周围最近且等距离的Br-数目为__。
③若该光敏钙钛矿的摩尔质量为M g·mol-1,晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g.cm-3(用含M、a、NA的代数式表示)。
(3)石墨炔的结构如图3所示,其中碳原子的轨道杂化类型是 _____ ,36 g石墨炔中含有σ键的数目为____。
【答案】1s22s22p63s23p63d24s2或[Ar]3d24s2 3 CH3CH3 N>O>C 共价键,配位键 PbCH3NH3Br3 12 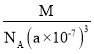 sp2、sp 3.5NA
sp2、sp 3.5NA
【解析】
(1)Ti是22号元素,根据构造原理写出基态Ti原子的电子排布式;Sc原子的未成对电子数为2,根据核外电子排布规律寻找同周期中未成对电子数为2的其它元素;
(2)①与CH3NH3+互为等电子体的一种分子可以用C原子替换N原子与1个单位正电荷,为:CH3CH3;同周期随原子序数增大,原子半径逐渐减小,第一电离能呈增大趋势,N元素的2p能级为半充满稳定状态,失去第一个电子需要的能量更高,故第一电离能最高;CH3NH3+中含有的化学键类型有共价键,配位键;
②根据均摊法,计算晶胞中CH3NH3+、Pb2+、Br-的数目,进而判断化学式;顶点的CH3NH3+与面心Br-距离最近,每个面为2个晶胞共用,故每个CH3NH3+周围最近且等距离的Br-数目为12;
③根据上一问计算的微粒数,先计算晶胞的质量g,再计算晶体密度;
(3)判断C原子的价层电子对数,从而判断其杂化方式;石墨炔的晶胞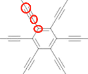 中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,再计算36g石墨炔的碳原子物质的量,进而计算含有σ键的数目。
中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,再计算36g石墨炔的碳原子物质的量,进而计算含有σ键的数目。
(1)Ti是22号元素,基态Ti原子的电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2;Sc原子的未成对电子数为2,同周期,基态原子与其未成对电子数相同,则元素原子的价电子排布式为3d84s2、4s24p2、4s24p4,共有3种;
故答案为:1s22s22p63s23p63d24s2或[Ar]3d24s2;3;
(2)①与CH3NH3+互为等电子体的一种分子可以用C原子替换N原子与1个单位正电荷,该等电子体分子为:CH3CH3;同周期随原子序数增大,原子半径逐渐减小,第一电离能呈增大趋势,N元素的2p能级为半充满稳定状态,失去第一个电子需要的能量更高,故第一电离能最高,第一电离能为:N>O>C;CH3NH3+中含有的化学键类型有共价键,配位键;
故答案为:CH3CH3;N>O>C;共价键,配位键;
②晶胞中,CH3NH3+数目为![]() ,Pb2+数目为1,Br-数目为
,Pb2+数目为1,Br-数目为![]() ,则化学式为PbCH3NH3Br;
,则化学式为PbCH3NH3Br;
顶点的CH3NH3+与面心Br-距离最近,每个面为2个晶胞共用,故每个CH3NH3+周围最近且等距离的Br-数目为12;
故答案为:PbCH3NH3Br3;12;
③晶胞质量为![]() g,晶体密度为
g,晶体密度为 ;
;
故答案为: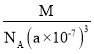 ;
;
(3)六元环上碳原子形成3个σ键,而碳碳三键中碳原子形成2个σ键,且均无孤电子对,则C原子的价层电子对数分别为3、2,分别采取sp2、sp杂化;石墨炔的晶胞 中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,36g石墨炔含有碳原子为
中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,36g石墨炔含有碳原子为![]() ,故含有σ键的数目为3.5NA;
,故含有σ键的数目为3.5NA;
故答案为:sp2、sp;3.5NA。,