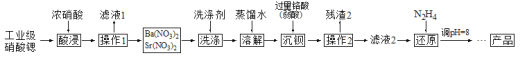
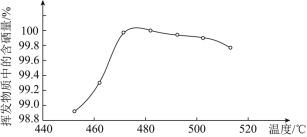
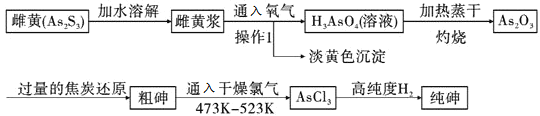
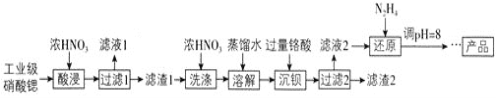
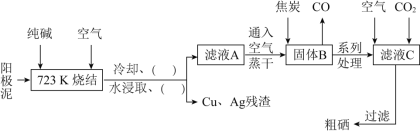【题目】工业合成氨反应为N2(g)+3H2(g) ![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=_________________________。
(2)上述反应的平衡常数K的表达式为_______________________________。
若反应方程式改写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填“大于”、“小于”或“等于”)v逆。
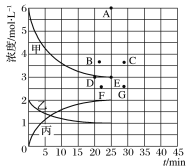
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是_____。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________________。
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论 |
A | 向黄色的 | 溶液变为紫红色 | 氧化性: |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中含有 |
C | 向 | 得到白色沉淀 | 相同温度下,溶度积常数: |
D | 一定温度下,向 | 溶液橙色变浅 | 减小 |
A.AB.B C.CD.D