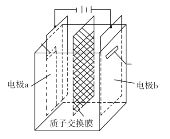
题目内容
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是
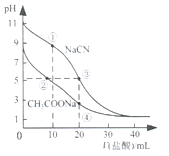
A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
【答案】D
【解析】
A、①为向0.1mol/L20.00mLNaCN溶液中加入0.1mol/L10.00mLHCl,反应后得到等物质的量浓度的NaCl、HCN和NaCN的混合液,由于溶液呈碱性,c(OH-)>c(H+),NaCN的水解程度大于HCN的电离程度,则溶液中c(HCN)>c(Cl-)>c(CN-)>c(OH-),A项错误;
B、②为向0.1mol/L20.00mLCH3COONa溶液中加入0.1mol/LHCl且加入盐酸的体积小于10.00mL,所得溶液含等物质的量浓度CH3COOH和NaCl、以及CH3COONa且CH3COONa的浓度大于NaCl,溶液呈酸性,故c(CH3COO-)>c(Cl-),B项错误;
C、②和③中c(H+)相等,但加入的盐酸体积不相等,溶液中c(Na+)不相等,②与③所示溶液中阳离子物质的量浓度之和不相等,C项错误;
D、④为向0.1mol/L20.00mLCH3COONa溶液中加入0.1mol/L20.00mLHCl,两者恰好完全反应得到物质的量浓度均为0.05mol/L的CH3COOH和NaCl的混合液,溶液中电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-),由钠离子和氯离子浓度相等,结合物料守恒得c(CH3COOH)+c(CH3COO-)=0.05mol/L,两式整理得c(CH3COOH)+c(H+)-c(OH-)=0.05mol/L,D项正确;
答案选D。

【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O