题目内容
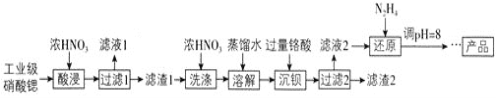
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
【答案】避免浓![]() 挥发和分解,减少环境污染
挥发和分解,减少环境污染 ![]() 减少硝酸锶的溶解损失
减少硝酸锶的溶解损失 ![]() 避免
避免![]() 在碱性溶液中发生反应
在碱性溶液中发生反应![]() 而溶解
而溶解 ![]() 偏高
偏高
【解析】
取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌,过滤,“滤液1”的主要溶质是Ca(NO3)2,“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2,并用浓HNO3洗涤滤渣,减少Sr(NO3)2溶解,进一步洗掉附着的Ca(NO3)2,将滤渣1溶于水中,加过量铬酸使Ba2+沉淀,“滤渣2”的主要成分为BaCrO4,“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,调节pH至7~8,Cr3+使转化为Cr(OH)3沉淀,过滤分离,将滤液经过蒸发浓缩、冷却结晶、过滤洗涤、干燥得产品,以此解答该题。
![]() 酸浸不能采用高温的原因是避免浓
酸浸不能采用高温的原因是避免浓![]() 挥发和分解,减少环境污染;工业级硝酸锶含硝酸钙、硝酸钡等杂质,利用浓硝酸酸浸后得到的滤渣1为
挥发和分解,减少环境污染;工业级硝酸锶含硝酸钙、硝酸钡等杂质,利用浓硝酸酸浸后得到的滤渣1为![]() 、
、![]() ,则滤液1的主要溶质是
,则滤液1的主要溶质是![]() 。
。
![]() 浓硝酸中含有的
浓硝酸中含有的![]() 浓度较高,根据同离子效应,用浓硝酸洗涤可以减少硝酸锶的溶解损失。
浓度较高,根据同离子效应,用浓硝酸洗涤可以减少硝酸锶的溶解损失。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出的无污染气体为氮气,根据得失电子守恒可知,反应中消耗
,同时放出的无污染气体为氮气,根据得失电子守恒可知,反应中消耗![]() 和
和![]() 的物质的量之比应为
的物质的量之比应为![]() ,结合原子守恒、电荷守恒和已知信息
,结合原子守恒、电荷守恒和已知信息![]() ,可得反应的离子方程式为
,可得反应的离子方程式为![]() 。
。
![]() 已知
已知![]() 类似氢氧化铝,为两性氢氧化物,能够与强碱反应,故还原后溶液的pH不能大于8的原因是避免
类似氢氧化铝,为两性氢氧化物,能够与强碱反应,故还原后溶液的pH不能大于8的原因是避免![]() 在碱性溶液中发生反应
在碱性溶液中发生反应![]() 而溶解。
而溶解。
![]() 酸性条件下
酸性条件下![]() 与HI反应的离子方程式为
与HI反应的离子方程式为![]() ,结合反应:
,结合反应:![]() ,可得关系式:
,可得关系式:![]() 则:
则:
![]() =
= ![]() mol×
mol×![]() ,即
,即![]() ;
;
![]() 若加入的HI溶液过量太多,部分HI会被空气中的
若加入的HI溶液过量太多,部分HI会被空气中的![]() 氧化,使测定结果偏高。
氧化,使测定结果偏高。

 阅读快车系列答案
阅读快车系列答案