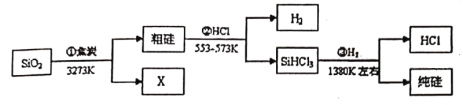
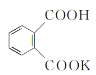
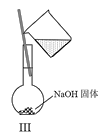
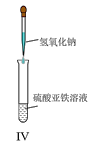
【题目】实验室中某些气体的制取、收集、尾气处理![]() 或性质实验
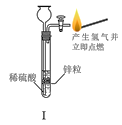
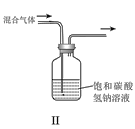
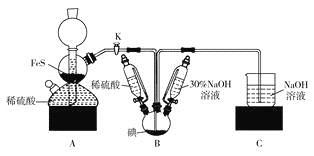
或性质实验![]() 装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是
装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是![]()
选项 | Ⅰ中的物质 | Ⅱ中收集的气体 | Ⅲ中的物质 |
|
A | Cu和稀硝酸 | NO | NaOH溶液 | |
B | 浓盐酸和 |
| NaOH溶液 | |
C | 亚硫酸钠和浓硫酸 |
| 品红溶液 | |
D | 浓氨水和CaO |
| 酚酞溶液 |
A.AB.BC.CD.D
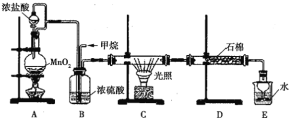
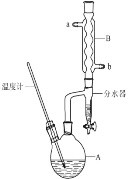
【题目】正丁醚常作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。
请回答:
(1)步骤①中还需要加入____,加热A前,需向B中通入水,____(填“a”或“b”)是B的出水口。
(2)步骤③的目的是初步洗去____,振摇后静置,粗产物应从分液漏斗的____(填“上口”或“下口”)分离出。
(3)步骤④中最后一次水洗的作用为____。
(4)步骤⑤中,加热蒸馏时应收集(填选项字母)____左右温度的馏分。
a.100℃ b.117℃ c.135℃ d.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是____。
(6)本实验中,正丁醚的产率为____。