题目内容
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1) 铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为________。
②与NO3-互为等电子体的一种分子为________(填化学式)。
(2) 邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
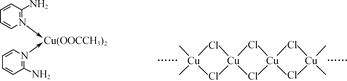
① C、N、O三种元素的第一电离能由大到小的顺序为________。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为________。
③ 1 mol ![]() 中含有σ键的数目为________mol。
中含有σ键的数目为________mol。
(3) 铜的某种氯化物的链状结构如图所示。该氯化物的化学式为________。
【答案】1s22s22p63s23p63d9或[Ar]3d9 SO3或BF3 N>O>C sp2、sp3 13 CuCl2
【解析】
(1) ①铜的原子序数为29,依据泡利原理、洪特规则书写其离子的电子排布式;
②依据等电子体原理分析作答;
(2) ①同周期中,第一电离能呈增大趋势,第IIA族和第VA族核外电子最高能级上电子为全充满和半充满结构,处于稳定状态,第一电离能较后一主族大,据此分析;
②依据杂化轨道理论分析其杂化类型;
③根据化学键的特点,两个形成共价键的原子间只能形成1个σ键,据此计算;
(3)利用均摊法分析。
(1) ①铜的原子序数为29,其电子排布式为:[Ar]3d104s1,Cu2+是铜原子失去2个电子以后的离子,其电子排布式为:1s22s22p63s23p63d9或[Ar]3d9;
②NO3-的原子个数为4,价电子数为24,从相邻或同族元素原子考虑,则与NO3-互为等电子体的分子为:SO3或BF3;
(2)①同周期中,第一电离能呈增大趋势,N的2p能级为半充满结构,处于稳定状态,第一电离能较O大,则C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;
②根据结构简式可以看出,形成4个单键的中心C原子的杂化轨道类型为sp3,羧基上的C与邻氨基吡啶中的C原子采用sp2杂化,为平面结构,故答案为sp2、sp3;
③ 1 mol ![]() ,成键原子的化学键有13mol,则含有σ键的数目为13mol;
,成键原子的化学键有13mol,则含有σ键的数目为13mol;
(3)从平面图中可以看出,一个Cu原子周围有4个Cl原子,一个Cl原子周围有2个Cu原子,则Cu与Cl的原子个数比为:1:2,即其化学式为CuCl2。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
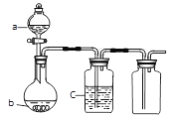
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D