题目内容
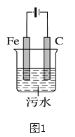
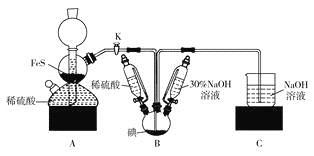
【题目】利用甲烷与氯气发生取代反应来生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
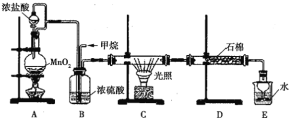
(1)A中制取Cl2的反应的化学方程式是________________________。
(2)B装置的作用:①;________;②________;③________。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________________________。
(4)E装置的作用有________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液
MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液
【解析】
装置A中,MnO2与浓盐酸反应生成MnCl2、Cl2和H2O;装置B中,生成的Cl2中混有水蒸气,可被浓硫酸除去,另外,B装置还可使气体均匀混合、通过观察气泡来控制气体流速。装置C中,CH4与Cl2在光照条件下发生取代反应;装置D中,未反应的Cl2可用KI除去;装置E中,用水吸收HCl生成盐酸,而有机产物二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层。
(1) MnO2与浓盐酸反应生成MnCl2、Cl2和H2O,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)由以上分析可知,B装置不仅具有干燥Cl2的作用,还能控制气体流速、混匀气体,从而得出B装置的作用是干燥气体、使气体混合均匀、通过观察气泡来控制气流速度。答案为:控制气流速度、使气体混合均匀、干燥气体;
(3)湿润的![]() 可与过量的氯气反应,从而除去过量的Cl2。答案为:除去过量的Cl2;
可与过量的氯气反应,从而除去过量的Cl2。答案为:除去过量的Cl2;
(4)E装置用来吸收产生的HCl,并防止倒吸现象的发生,故选C。答案为:C;
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,液体分层,可通过分液的方法分离出盐酸。答案为:分液。

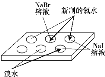
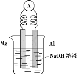
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D