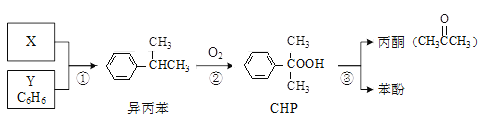
题目内容
【题目】废水中氨氮(NH3、NH![]() )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
(1) 氨氮污水直接排放入河流、湖泊导致的环境问题是________。
(2) 生物脱氮法:利用微生物脱氮,原理如下:
NH![]()
![]() NO
NO![]()
![]() N2
N2
反应①的离子方程式为__________________________________。
(3) 化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,NH![]() 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
(4) 折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O===HClO+NaOH(Ⅰ)
NH3+HClO===NH2Cl+H2O(Ⅱ)
NH2Cl+HClO===NHCl2+H2O(Ⅲ)
NHCl2+H2O===NOH+2HCl(Ⅳ)
NHCl2+NOH===N2↑+HClO+HCl(Ⅴ)
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
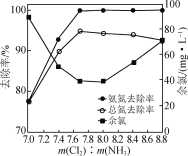
①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是__________________。
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是____________________________。
(5) 电催化氧化法:原理如下图所示(MOx表示催化剂)。反应Ⅱ的离子方程式可表示为2NH4++6MOx(·OH)===6MOx+N2↑+6H2O+2H+。
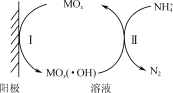
①阳极电极反应式Ⅰ为________________________________。
②电催化氧化法除氨氮时,若其他条件相同时,含Cl-的污水比不含Cl-的污水氨氮去除率要高,其原因是________________________________。
【答案】水体富营养化 NH4++2O2![]() NO3-+2H++H2O MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O 次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3- 加入次氯酸钠量不足,部分氨氮以NH2Cl形式存在 MOx+H2O-e-===MOx(·OH)+H+ Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去
NO3-+2H++H2O MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O 次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3- 加入次氯酸钠量不足,部分氨氮以NH2Cl形式存在 MOx+H2O-e-===MOx(·OH)+H+ Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去
【解析】
(1)水体中N、P等营养盐含量过多而引起的水质污染,导致水体富营养化;
(2)铵根与氧气在硝化细菌的作用下生成硝酸根离子和水;
(3)沉淀会溶解在过量的碱性环境中;
(4)①次氯酸钠氧化性较强,若投入量过大,则部分N元素会被氧化为硝酸根离子;
②次氯酸钠投入量过少,发生次氯酸会将氨气按反应Ⅱ氧化为NH2Cl;
(5)①依据电解原理,阳极发生失电子的氧化反应,据此分析;
②根据放电顺序,电解质溶液中有氯离子的话氯离子先放电,氯气溶于水形成的次氯酸参与氨氮的去除反应。
(1)氨氮污水直接排放入河流、湖泊导致水体富营养化;
(2)根据图示信息可知,反应①的离子方程式为NH4++2O2![]() NO3-+2H++H2O;
NO3-+2H++H2O;
(3)若pH过大,MgNH4PO4·6H2O会与氢氧根离子反应转化成氢氧化镁,其离子方程式为:MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O;
(4)①当m(Cl2)∶m(NH3)≥7.7时,次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3-;
②当m(Cl2)∶m(NH3)<7.7时,说明次氯酸投入量小,此时部分氨氮以NH2Cl形式存在;
(5)①依据电解原理,阳极MOx失电子转化为MOx(·OH),其电极反应式为:MOx+H2O-e-===MOx(·OH)+H+;
②电催化氧化法除氨氮时,若其他条件相同时,污水若有Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去,因此含Cl-的污水比不含Cl-的污水氨氮去除率要高。

 优翼小帮手同步口算系列答案
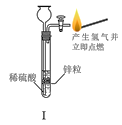
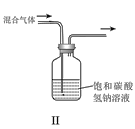
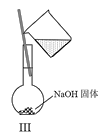
优翼小帮手同步口算系列答案【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
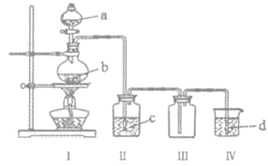
Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
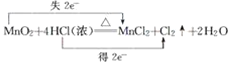
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D