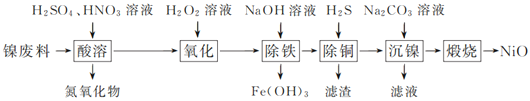
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
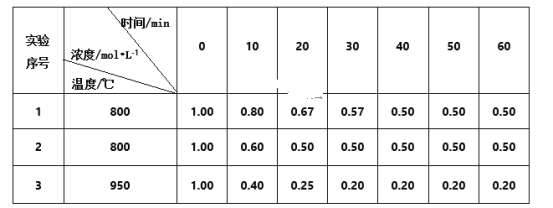
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
【题目】“84消毒液”(NaClO含量为8~10%,另含少量NaCl)置于空气中会逐渐变质,同学们对其成分(水除外)作如下探究:
⑴查阅资料
①“84消毒液”有漂白性和碱性,呈碱性的原因是 ______ (用离子方程式解释)。
电离方程 | H2CO3 | HCO3- | HClO |
电离常数 | K1 =4.4×10-7 | K2 =4.7×10-11 | K =3×10-8 |
②化学上用电离常数衡量弱电解质的电离能力。
③常温下,Ca(ClO)2溶解度为21g;Cl2在饱和食盐水中的溶解度小。
⑵提出假设甲同学根据是否变质和变质情况作出如下假设:
假设一:只含NaCl、NaClO。
假设二:肯定含NaCl,可能含NaClO、NaHCO3、Na2CO3中至少一种,推测含NaHCO3的依据是 ______ (用方程式解释)。
假设三:只含NaCl。
⑶实验验证可选用药品:AgNO3溶液、稀硝酸、澄清石灰水、酚酞、CaCl2溶液
①甲同学取适量“84消毒液”样品于一支试管中,滴加澄清石灰水,出现白色沉淀,判定样品含Na2CO3。
乙同学认为甲的判断不准确,不能仅凭白色沉淀就确定含Na2CO3因为 ______(用离子方程式解释),为此乙同学在甲的基础上继续实验:另取少量样品,滴加CaCl2溶液,无白色沉淀。
②请你设计实验证明假设三不成立______。
③根据上述实验结果,该样品中一定含有______(填化学式)。
⑷定量检测
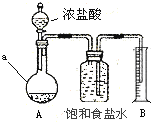
依据原理:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O,设计测定NaClO含量的实验如下:
取10g“84消毒液”样品,加足量Ca(OH)2至沉淀完全,过滤并洗涤沉淀,将滤液和洗涤液合并混匀后加入下图装置A中(加热装置已略去),然后加入浓盐酸,当不再有气体生成时,B中得到224 mL液体(折合到标准状况),a仪器的名称是______,实验测得原样品中NaClO的质量分数为 ______。