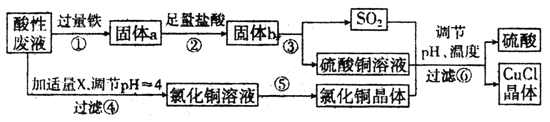
题目内容
【题目】某可逆反应:2A(g)![]() B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
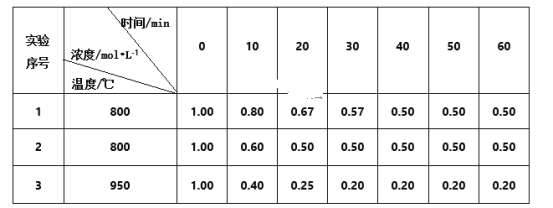
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为___mol·L-1·min-l,50min时,v正___v逆(填“<”“>”或“=”)。
(2)0~20min内,实验2比实验1的反应速率___(填“快”或“慢”),其原因可能是___。
(3)实验3比实验1的反应速率__(填“快”或“慢”),其原因是__。
【答案】0.013 = 快 实验2中使用了催化剂 快 实验3温度升高加快了反应速
【解析】
(1)由v=![]() 计算反应速率,50min时,浓度不再发生变化,反应达到平衡状态;
计算反应速率,50min时,浓度不再发生变化,反应达到平衡状态;
(2)根据达到平衡状态所需时间判断反应进行的快慢;
(3)根据达到平衡状态所需时间判断反应进行的快慢,再根据温度判断原因。
(1)v(A)=![]() =
=![]() =0.013 mol·L-1·min-l;50min时,浓度不再发生变化,反应达到平衡状态,则v正=v逆;
=0.013 mol·L-1·min-l;50min时,浓度不再发生变化,反应达到平衡状态,则v正=v逆;
(2)实验2在20min时达到平衡,实验1在40min时达到平衡,实验2达到平衡状态所需时间短,说明实验2比实验1的反应速率快;在其他条件均相同的条件下,增加催化剂可使反应速率加快;
(3)实验3在30min时达到平衡,实验1在40min时达到平衡,实验3达到平衡状态所需时间短,说明实验3比实验1的反应速率快;实验3与实验1相比,温度升高,反应速率加快,达到平衡所需时间缩短。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目