题目内容
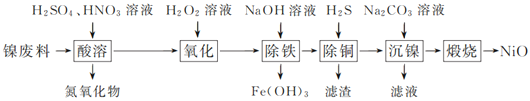
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
【答案】温度低于70 ℃,反应速率降低,温度高于80 ℃,HNO3分解(或挥发)加快 2Fe2++H2O2+2H+=2Fe3++2H2O 3.2≤pH<4.2 CuS xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
(x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
【解析】
以镍废料(主要成分为镍铁合金,含少量铜)为原料,加入硫酸、硝酸酸浸,Ni转化为NiSO4,同时生成亚铁离子、铁离子、铜离子等,加入过氧化氢,可氧化亚铁离子生成铁离子,加入氢氧化钠调节pH可生成氢氧化铁沉淀,然后通入硫化氢生成CuS沉淀,达到除铜的目的,在滤液中加入碳酸钠溶液可生成xNiCO3yNi(OH)2,煅烧可生成NiO,以此解答该题。
(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃,原因是温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快,故答案为:温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快;
(2)“氧化”时,Fe2+参加反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)“除铁”时,应使铁完全沉淀,且避免生成氢氧化铜,由表中数据可知,需控制溶液的pH范围为3.2≤pH<4.2,故答案为:3.2≤pH<4.2;
(4)由以上分析可知通入硫化氢生成CuS沉淀,故答案为:CuS;
(5)①在隔绝空气条件下,“煅烧”xNiCO3yNi(OH)2得到NiO,该反应的化学方程式为xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O,故答案为:xNiCO3·yNi(OH)2
(x+y)NiO+xCO2↑+yH2O,故答案为:xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O;
(x+y)NiO+xCO2↑+yH2O;
②“沉镍”时,溶液pH增大,可生成Ni(OH)2,导致碱式碳酸镍中Ni(OH)2比例增大,而Ni(OH)2中Ni含量高于NiCO3,则碱式碳酸镍中Ni元素含量会增加,故答案为:Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大。

【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
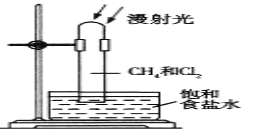
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
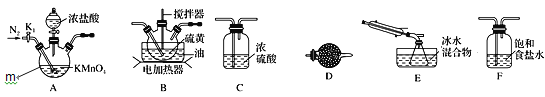
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
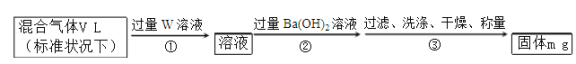
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
【题目】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是___(填字母)。
(2)下列操作合理的是___(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用240 mL容量瓶配制240mL 1 mol·L-1的氢氧化钠溶液
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为___mL。

(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.05 | 26.05 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.36 | 26.31 | 25.95 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度:c(NaOH)=___mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___(填字母)。
A.滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.锥形瓶用待测碱液润洗
D.滴定时酸式滴定管中盐酸洒落在锥形瓶外