【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
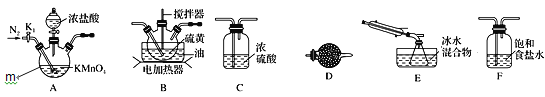
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
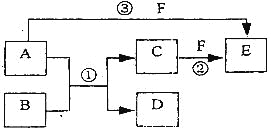
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
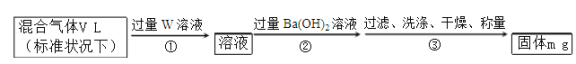
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
【题目】黄钾铁矾渣经如下流程可将其转化为锰锌铁氧体:

已知:①黄钾铁矾渣中铁主要以Fe2O3形式存在,锌主要以硫酸锌(ZnSO4)、氧化锌(ZnO)、硅酸锌(ZnSiO3)形式存在,黄钾铁矾渣的某些元素成分如下表所示:
元素 | Fe | Zn | Cu | Cd | Ca | Mg | Si |
质量分数 | 28.9 | 8.77 | 0.37 | 0.18 | 0.37 | 0.84 | 4.63 |
②NH4F溶液用于沉淀Mg2+和Ca2+,②Fe和Cd的金属活动性相近
⑴“酸浸”后,滤渣1的主要成分为________(写化学式);为了提高浸出率,可采取的措施有________(写出一种即可)。
⑵“还原除杂”工序中,加入铁粉是为了除去溶液中________、________等金属杂质离子。
⑶加入(NH4)2S沉淀Cd2+时应避免过量,原因是________;若此过程中溶液搅拌时间过长,则会导致Cd2+去除率偏低,原因是________。(已知:CdS的溶度积Ksp = 8×10-27,FeS的溶度积Ksp = 4×10-19,ZnS的溶度积Ksp = 1.6×10-24)
⑷写出“共沉淀”工序中生成FeCO3的离子反应方程式为:________。
⑸锰锌铁氧体是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:

①写出除锰(Mn2+)步骤中的离子方程式________。
②准确量取25.00 mL溶液A,掩蔽铁后,用二甲酚橙作指示剂,用0.0100mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+ (反应原理为Zn2+ + H2Y2- =ZnY 2- + 2H+),至滴定终点时消耗EDTA标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数为________。