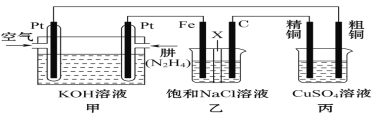
题目内容
【题目】A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。
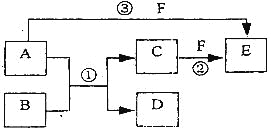
(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
【答案】4NH3+5O2![]() 4NO+6H2O 3.612×1024 酸 c(NH4+) c(Cl-) c(NH3·H2O) 2Al+2OH-+2H2O=2AlO2-+3H2↑ O2+2H2O+4e-=4OH- 4Al+3O2+6H2O=4Al(OH)3
4NO+6H2O 3.612×1024 酸 c(NH4+) c(Cl-) c(NH3·H2O) 2Al+2OH-+2H2O=2AlO2-+3H2↑ O2+2H2O+4e-=4OH- 4Al+3O2+6H2O=4Al(OH)3
【解析】
B、C、F都是气态单质,且B为黄绿色,因此B是氯气。A是—种极易溶于水的气体,A和D相遇有白烟生成,这说明A应该是氨气,D是氯化氢。由于氯气具有强氧化性,且反应①是置换反应,因此反应①是氯气与氨气发生的氧化还原反应,生成物是氮气与氯化氢,其中C是氮气。反应②需要放电才能发生,因此F是氧气,在放电的条件下与氮气反应生成NO,则E是NO。反应③中有水生成,所以该反应是氨气与氧气发生的催化氧化生成NO与水,结合题目要求和物质的性质可解答该题。
B、C、F都是气态单质,且B为黄绿色,因此B是氯气。A是—种极易溶于水的气体,A和D相遇有白烟生成,这说明A应该是氨气,D是氯化氢。由于氯气具有强氧化性,且反应①是置换反应,因此反应①是氯气与氨气发生的氧化还原反应,生成物是氮气与氯化氢,其中C是氮气。反应②需要放电才能发生,因此F是氧气,在放电的条件下与氮气反应生成NO,则E是NO。反应③中有水生成,所以该反应是氨气与氧气发生的催化氧化生成NO与水,
(1)反应③的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)在反应①中氮元素的化合价从-3价升高到0价失去3个电子,因此每生成1mol氮气转移6mol电子,其电子数为6.02×1023/mol×6mol=3.612×1024;
(3)盐酸与氨水恰好反应时生成氯化铵,由于溶液中NH4+水解,所以溶液显酸性;
①根据电荷守恒可知,在氯化铵溶液中存在c(H+) + c(NH4+)=c(OH-)+ c(Cl-);
②根据物料守恒可知c(Cl-)=c(NH3·H2O)+ c(NH4+),则根据电荷守恒可知,溶液中c(H+)=c(OH-)+ c(NH3·H2O);
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则X应该是金属铝;
①铝单质与碱反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
②原电池中较活泼的金属失去电子,发生氧化反应,电子沿导线传递到正极,正极得到电子发生还原反应。所以该原电池中负极是铝,正极是氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。由于负极是铝失去电子,产生的铝离子与OH-结合生成氢氧化铝,所以总反应式为4Al+3O2+6H2O=4Al(OH)3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
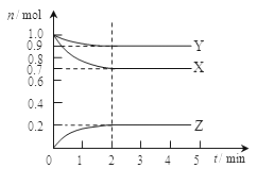
小学生10分钟应用题系列答案【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:![]()
![]()
![]() 。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式_______________。
(2)前2s内的平均反应速率![]() __________;达到平衡时,CO的转化率为__________。
__________;达到平衡时,CO的转化率为__________。