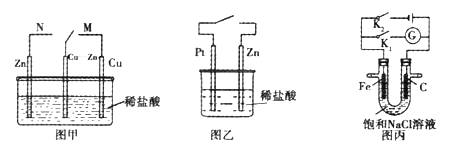
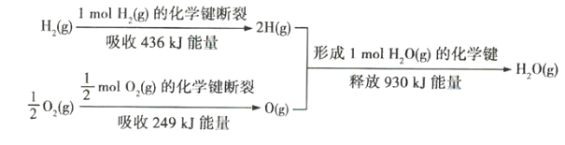
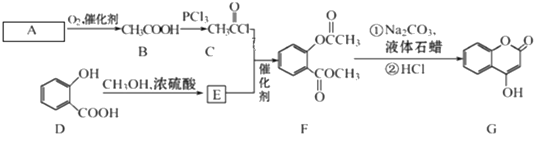
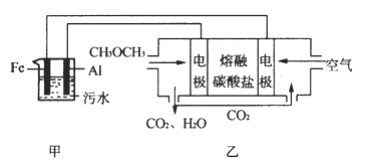
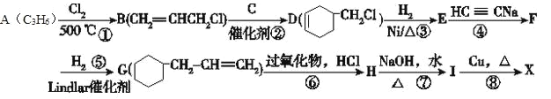
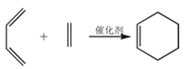
0 200512 200520 200526 200530 200536 200538 200542 200548 200550 200556 200562 200566 200568 200572 200578 200580 200586 200590 200592 200596 200598 200602 200604 200606 200607 200608 200610 200611 200612 200614 200616 200620 200622 200626 200628 200632 200638 200640 200646 200650 200652 200656 200662 200668 200670 200676 200680 200682 200688 200692 200698 200706 203614