【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
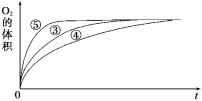
分析该图能够得出的实验结论是___________。
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D
