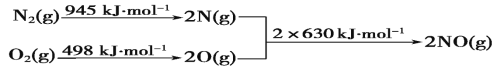
题目内容
【题目】下列有关实验原理或操作方法正确的是( )
A.在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性
B.实验室从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取
C.燃料电池制作实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果更好
D.润洗滴定管时应从滴定管上口加入润洗溶液,倾斜着转动滴定管使液体润湿内壁,再从上口倒出,重复2-3次
【答案】C
【解析】
![]() 漂白粉中含氯化钙、次氯酸钙,在酸性溶液中发生氧化还原反应生成黄绿色气体为氯气,硫酸只体现其酸性,故A错误;
漂白粉中含氯化钙、次氯酸钙,在酸性溶液中发生氧化还原反应生成黄绿色气体为氯气,硫酸只体现其酸性,故A错误;
B.碘以离子形式存在,需要加氧化剂氧化为碘单质,则从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 氧化
氧化![]() 萃取,故B错误;
萃取,故B错误;
C.用![]() 溶液或
溶液或![]() 溶液代替蒸馏水导电性增强,且电解质不参加电极反应,效果更好,故C正确;
溶液代替蒸馏水导电性增强,且电解质不参加电极反应,效果更好,故C正确;
D.润洗后,从滴定管的下口放出,不能从上口倒出,其他操作均合理,故D错误;
选C。

【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1