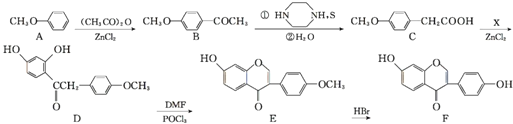
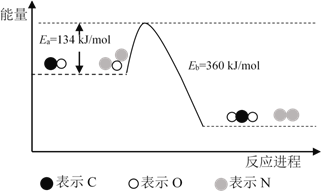
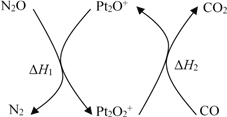
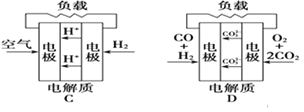
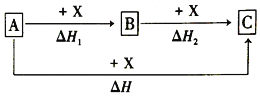
【题目】根据下列实验操作和观察到的现象,得出的结论一定是正确的是( )
实验操作 | 现象 | 结论 | |
A |
| 溴水褪色 |
|
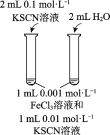
B | 将硫酸酸化的 | 溶液变成黄色 | 氧化性: |
C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入 |
| 乙烯使 |
D | 向a、b两支盛有 | a试管中溶液变蓝 b试管中产生黄色沉淀 |
|
A.AB.BC.CD.D
【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1 mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
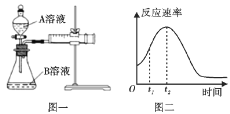
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)__mol·L-1(假设混合液体积为50mL)。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
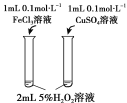
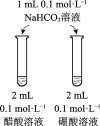
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D