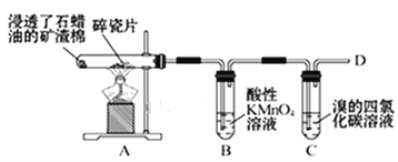
题目内容
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是

A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1molL-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
【答案】C
【解析】
图中装置为双液原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚氢硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题;
A.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1022个电子转移时,即0.02mol电子转移时,乙中生成0.03molH+,c(H+)=0.03mol/0.3L=0.1mol/L,故不选A;
B.甲为正极,电池工作时,阳离子移向正极,故不选B;
C.电池工作时,外电路的电子方向应该从负极到正极,即从b到a,故选C;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故不选D;
答案:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目