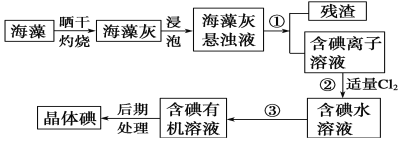
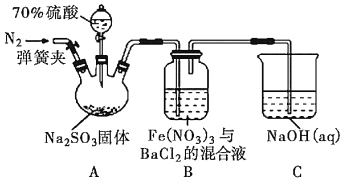
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)反应Ⅰ的化学平衡常数表达式是K=_______________________________。
(2)一定温度下,在容积可变的密闭容器中进行反应Ⅱ,不能确定上述可逆反应已达到化学平衡状态的是_____________
A.体系的体积不再发生变化 B.生成n mol CO的同时消耗n mol H2O
C.混合气的密度不再改变 D.1 mol H—H键断裂的同时断裂2 mol H—O键
(3)某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同的反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
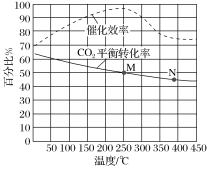
①对比表中①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________________________________;
②对比表中①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因___________________________________________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有____________。
a.使用Cu/ZnO纳米棒做催化剂 b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度 d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
(4)反应混合气体经过降温加压可分离出甲醇,剩余气体可再次充入反应器继续反应,经过多次循环往复后混合气体中CO的含量已经很高,可以在另外容器中在合适的催化剂条件下使CO和H2反应合成CH3OH(g),写出该反应的热化学方程式:_______________________________。
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
【题目】有一溶液,欲确定是否含有下列离子:K+、Mg2+、Fe3+、Ba2+、SO42-、Cl-、I-、HCO3-,实验如下:
实验步骤 | 实验现象 |
①用玻璃棒蘸取少量该溶液,点在pH试纸中部 | 试纸变为红色 |
②取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
③取②中反应后的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
④取少量该溶液,加入NaOH溶液 | 只有红褐色沉淀生成 |
下列判断正确的是( )
A.溶液中阳离子只有Fe3+
B.由于没有Na+,焰色反应观察K+时不必用蓝色的钴玻璃
C.假如没有步骤①,也不影响溶液中离子的判断
D.步骤④发生反应的离子方程式只有:Fe3++3OH-=Fe(OH)3↓