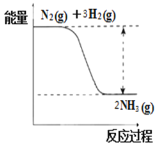
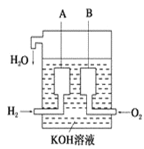
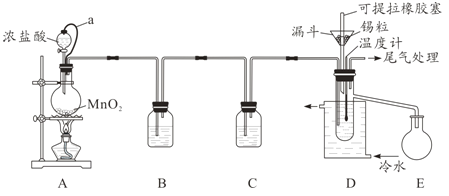
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
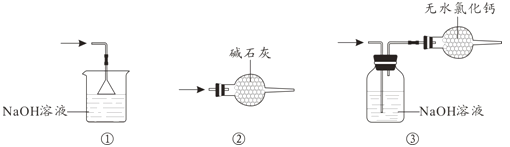
(4)尾气处理时,可选用的装置是__________(填序号)。
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。