【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
(1)已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___。
(2)某研究性学习小组在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后进行反应CO(g)+2H2(g)=CH3OH(g) ΔH<0。
①下列措施中有利于增大该反应的反应速率且提高转化率的是__(填字母序号)
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.使用高效催化剂 D.增大体系压强
②实验过程中用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以H2表示的平均反应速率=__mol/(L·min),该温度下平衡常数k=__。
③若在恒温恒压条件下进行上述反应,达到平衡后,往体系中通入一定量的稀释剂(水蒸气),CO的转化率__(填"增大"、"减小"或"不变")。
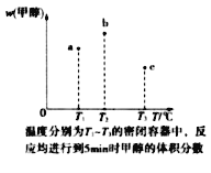
(3)现在容积均为1L的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b中甲醇体积分数大于a中的原因是__。达到平衡时,a、b、c中CO的转化率大小关系为__。