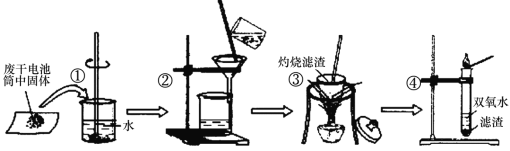
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
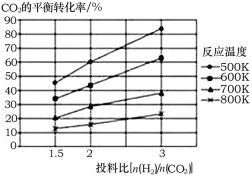
①ΔH1______(填写“>”或“<”)0;
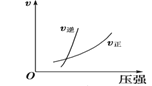
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
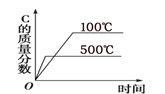
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 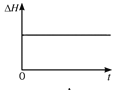 B.
B. 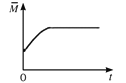 C.
C. 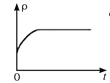 D.
D. 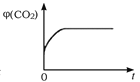
【题目】回答下列问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式_________________________。
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) ![]() 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl- Cl | Cl-N | N=O |
键能/kJ·mol-1 | 630 | 243 | a | 607 |
则2NO(g)+C12(g) ![]() 2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。