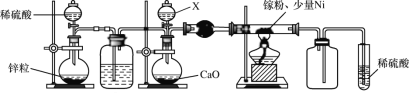
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
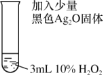
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
【题目】实验室中有一未知浓度的醋酸,某学生用0.1000 mol·L-1 NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验编号 | 待测醋酸的体积/mL | NaOH溶液的浓度/mol·L-1 | 消耗NaOH溶液的体积/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
(1)该实验中指示剂最好选用___________,滴定达到终点的标志是_____________________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度为_________mol·L-1(保留小数点后4位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
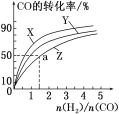
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
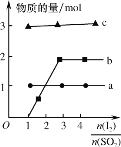
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。