题目内容
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
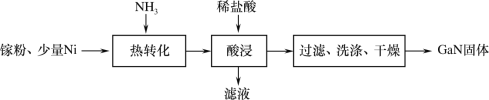
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
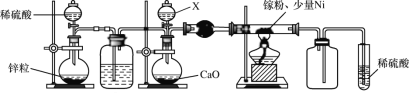
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
【答案】第四周期ⅢA族 2Ga+2NH3![]() 2GaN+3H2 除去GaN中混有的少量Ni 浓氨水 排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸
2GaN+3H2 除去GaN中混有的少量Ni 浓氨水 排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸 ![]() %
%
【解析】
(1)由流程图可知,在少量Ni做催化剂作用下,Ga粉与氨气高温下反应生成GaN和H2,反应得到混有Ni的GaN混合物,向反应后的固体中加入稀盐酸,Ni溶于稀盐酸生成可溶的氯化镍,GaN不与稀盐酸反应,过滤、洗涤、干燥得到GaN;
(2)由实验装置图可知,实验时,应先制备氢气,利用氢气排除装置中的空气,避免空气与镓反应,防止空气中氧气和反应生成的氢气加热混合发生爆炸,当装置中空气排尽后,再用浓氨水与氧化钙反应制备氨气,在少量Ni做催化剂作用下,Ga粉与氨气加热反应生成GaN和H2,由于氨气与稀硫酸反应,在吸收装置前连接一个空载仪器,起防止倒吸的作用。
(1)镓的原子结构示意图为![]() 可知,镓原子有4个电子层,最外层有3个电子,则镓元素位于周期表第四周期ⅢA族,故答案为:第四周期ⅢA族;
可知,镓原子有4个电子层,最外层有3个电子,则镓元素位于周期表第四周期ⅢA族,故答案为:第四周期ⅢA族;
②由流程图可知,“热转化”的过程为在少量Ni做催化剂作用下,Ga粉与氨气高温下反应生成GaN和H2,反应的化学方程式为2Ga+2NH3![]() 2GaN+3H2,故答案为:2Ga+2NH3
2GaN+3H2,故答案为:2Ga+2NH3![]() 2GaN+3H2;
2GaN+3H2;
③由分析可知反应得到混有Ni的GaN混合物,酸浸的目的是使Ni溶于稀盐酸,除去GaN中混有的少量Ni,故答案为:除去GaN中混有的少量Ni;
(2)①仪器X中的试剂是浓氨水,目的是用浓氨水与氧化钙反应制备氨气;空气中的氧气能与镓反应,且镓与氨气反应生成的氢气能与空气中氧气反应,发生爆炸,所以加热前需先通入一段时间的H2,排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸,故答案为:排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸;
②由题给化学方程式可得如下关系式:GaN—NH3—NH3H3BO3—HCl,由关系式可知n(GaN)=n(HCl)=10-3cVmol,则样品的纯度为![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %。
%。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案