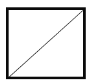
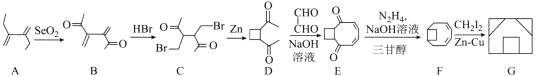
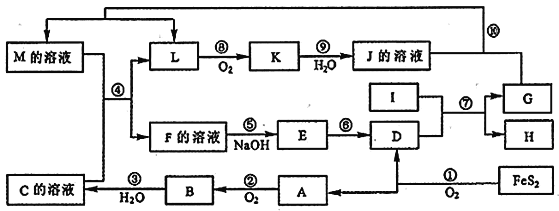
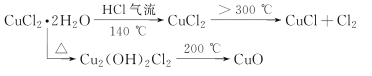【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
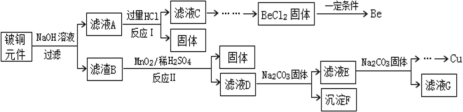
已知:I、铍、铝元素化学性质相似;BeCl2熔融时能微弱电离;
Ⅱ、常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10—20 | 4.0×10—38 | 2.1×10—13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
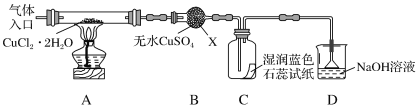
②从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:__________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.0080mol·L-1、c(Mn2+)=0.010mol·L-1,缓慢通氨气调节pH可将其依次分离(体积变化忽略不计)。当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5 mol·L-1)时,溶液中c(Cu2+)/ c(Fe3+)约为______。(![]() ≈4.7,保留两位有效数字)
≈4.7,保留两位有效数字)
(5)电解NaCl-BeCl2混合熔盐可制备金属铍。
①电解过程中,加入氯化钠的目的是________。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为________。已知部分物质的熔沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
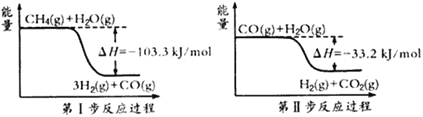
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___________________,反应消耗1mol NaBH4时转移的电子数目为_______。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
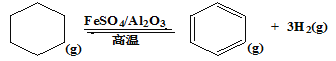
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________________(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
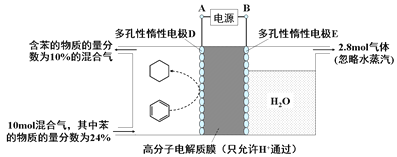
①实现有机物储氢的电极是________;
A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:________________________。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是_________。由表中数据可知,此装置的电流效率η=______________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。