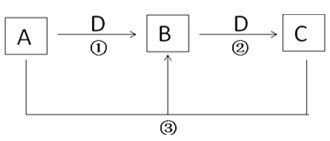
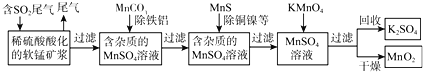
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:
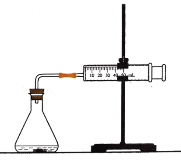
(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关
【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。