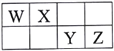
题目内容
【题目】SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
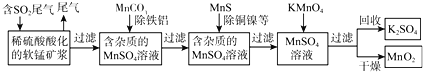
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______
【答案】MnO2(s)+SO2(g)=MnSO4(s) △H=-248kJ/mol 引入CO32-降低溶液中H+的浓度,促进Al3+、Fe3+的水解而除去铝和铁 取少量最后一次洗涤液于试管中,滴加适量的BaCl2溶液,未产生白色沉淀,则证明沉淀已洗涤干净
【解析】
(1)Mn(s)+O2(g)═MnO2(s) △H=-520kJmol-1
S(s)+O2(g)═SO2(g) △H=-297kJmol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s) △H=-1065kJmol-1
结合盖斯定律可知,将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s) △H=-248kJ/mol;
(2)第二步加入MnCO3其原因是引入CO32-降低溶液中H+的浓度,促进Al3+、Fe3+的水解而除去铝和铁;
(3)若最后一步所加KMnO4恰好反应完全,证明过滤所得的MnO2固体已洗涤干净的方法为取少量最后一次洗涤液于试管中,滴加适量的BaCl2溶液,未产生白色沉淀,则证明沉淀已洗涤干净。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
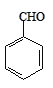 +Br2
+Br2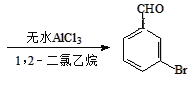 +HBr
+HBr
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
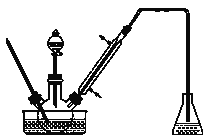
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______,锥形瓶中应为_______(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_________。
A >229℃ B 58.8℃~179℃ C <58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_______。
(5)步骤4中采用减压蒸馏,是为了防止_______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为___。
(7) ![]() 是一种重要的医药中间体。请设计合理方案用
是一种重要的医药中间体。请设计合理方案用![]() 合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
例如:![]()
![]()
![]()
![]()
![]()