题目内容
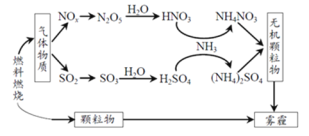
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
(1)NH3 的电子式是______。
(2)NH4NO3 溶液中的离子浓度由大到小顺序是_____。
(3)①已知:SO2 生成 SO3 总反应方程式是:2SO2(g)+O2(g)2SO3(g)。此反应可通过如下两步完成:2NO(g)+O2 (g ) 2NO2(g),写出第二步的化学方程式______。
②一定温度下,向 2 L 恒容密闭容器中充入 NO2 和 SO2 各 1 mol,5min 达到平衡,此时容器中 NO2 和
NO 的浓度之比为 1∶3,则 NO2 的平衡转化率是_____。
(4)利用NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝。
①制备少量NaClO2,其装置如下图所示:
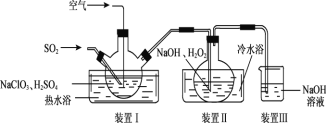
装置 I 控制温度在 35~55℃,通入 SO2 将 NaClO3 还原为 ClO2(沸点:11℃),反应的离子方程式是_____,装置 Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是___,反应后装置Ⅲ中溶液中阴离子除了 ![]() 、
、![]() 、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
②用制得的NaClO2/H2O2 酸性复合吸收剂同时对 NO、SO2 进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如下图所示:
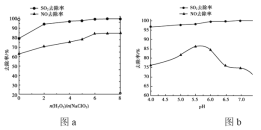
从图 a 和图 b 中可知脱硫脱硝最佳条件是 ______。图 b 中SO2 的去除率随 pH 的增大而增大,而NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是_______。
【答案】![]() c(
c(![]() ) > c(
) > c(![]() ) > c(H+) > c(OH-) NO2+SO2SO3+NO 75% SO2+2ClO-=2ClO2+
) > c(H+) > c(OH-) NO2+SO2SO3+NO 75% SO2+2ClO-=2ClO2+![]() ClO2
ClO2 ![]() pH在5.5~6.0,n(H2O2)/n(NaClO2) = 6:1 pH>5.5 以后,随着pH增大,NO 的还原性降低;或H2O2和NaClO2氧化性减弱,不能将 NO 氧化为硝酸
pH在5.5~6.0,n(H2O2)/n(NaClO2) = 6:1 pH>5.5 以后,随着pH增大,NO 的还原性降低;或H2O2和NaClO2氧化性减弱,不能将 NO 氧化为硝酸
【解析】
(1)氨气是氮原子和三个氢原子形成三个共价键形成的共价化合物,电子式:![]() 。故答案为:
。故答案为:![]() ;
;
(2)硝酸铵溶液中铵根离子水解溶液显酸性,NH4NO3 溶液中的离子浓度由大到小顺序是c(![]() ) > c(
) > c(![]() ) > c(H+) > c(OH-),故答案为:c(
) > c(H+) > c(OH-),故答案为:c(![]() ) > c(
) > c(![]() ) > c(H+) > c(OH-);
) > c(H+) > c(OH-);
(3)①已知:SO2 生成 SO3 总反应方程式是:Ⅰ.2SO2(g)+O2(g)2SO3(g)。此反应可通过如下两步完成:Ⅱ.2NO(g)+O2 (g ) 2NO2(g),盖斯定律计算(Ⅰ-Ⅱ)×![]() 得到第二步的化学方程式NO2+SO2 SO3+NO。故答案为:NO2+SO2 SO3+NO;
得到第二步的化学方程式NO2+SO2 SO3+NO。故答案为:NO2+SO2 SO3+NO;
②一定温度下,向 2 L 恒容密闭容器中充入 NO2 和 SO2 各 1 mol,5min 达到平衡,此时容器中 NO2 和NO 的浓度之比为 1∶3,结合三行计算列式得到,设消耗NO2的物质的量为x:
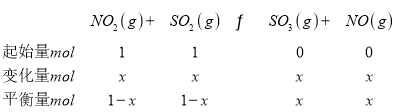
NO2和NO的浓度之比为1:3,物质的量之比=1:3,(1-x):x=1:3,x=0.75mol,NO2的平衡转化率=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(4)①装置 I 控制温度在 35~55℃,通入 SO2 将 NaClO3 还原为 ClO2(沸点:11℃),反应的离子方程式是SO2+2ClO-=2ClO2+![]() ,装置Ⅱ中反应生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,氧化剂为:ClO2 ,装置Ⅲ中的作用是吸收尾气中可能存在的二氧化硫、ClO2等,可以用氢氧化钠溶液吸收,溶液中阴离子除了
,装置Ⅱ中反应生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,氧化剂为:ClO2 ,装置Ⅲ中的作用是吸收尾气中可能存在的二氧化硫、ClO2等,可以用氢氧化钠溶液吸收,溶液中阴离子除了![]() 、
、![]() 、Cl-、ClO-、OH-外还可能含有的一种阴离子是
、Cl-、ClO-、OH-外还可能含有的一种阴离子是![]() 。故答案为:SO2+2ClO-=2ClO2+
。故答案为:SO2+2ClO-=2ClO2+![]() ;ClO2;
;ClO2;![]() ;
;
②从图a和图b中可知脱硫脱硝最佳条件是:pH在5.5~6.0 n(H2O2)/n(NaClO2)=6:1,图b 中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,NO去除率减小的可能原因是:pH>5.5以后,随着pH增大,NO的还原性降低;或H2O2和NaClO2氧化性减弱,不能将NO氧化为硝酸,故答案为:pH在5.5~6.0 n(H2O2)/n(NaClO2)=6:1;pH>5.5以后,随着pH增大,NO的还原性降低;或H2O2和NaClO2氧化性减弱,不能将NO氧化为硝酸。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____