【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
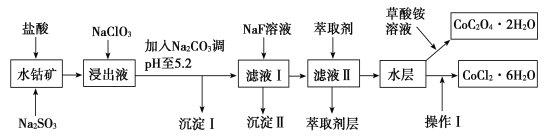
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]
【题目】氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。请回答下列问题:
Ⅰ.结晶法制取FeCl2
在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,____,______,固液分离,洗涤,快速干燥制得。
Ⅱ.氯苯还原无水FeC13制取FeC12
无水FeCl3与氯苯反应的化学方程式为:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
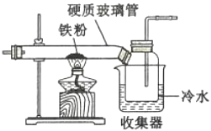
(1)如图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是________。
(2)利用如图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下:

C6H5C1(氯苯) | C6H4C12 | FeC13 | FeC12 | |
相对分子质量 | 112.5 | 147 | 162.5 | 127 |
熔点/℃ | -45 | 53 | 306 | 670~674 |
沸点/℃ | 132 | 173 | 315 | 1023 |
将162.5 g无水氯化铁和200 g氯苯加入到圆底烧瓶中,在锥形瓶中加入200 g滴有酚酞的9.5%的NaOH溶液。先通入N2一段时间,再加热,控制温度在132 ℃左右发生反应。实验完成后冷却,分离提纯得到粗产品。
①先通入N2的目的是_______;导管a的作用是______。
②当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过______%。
③实验结束后,回收过量氯苯的操作名称为______。
④指出装置c可能存在的缺点______。
【题目】CO在工农业生产及科学研究中有着重要的应用。
(1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为__________。
(2)CO催化脱氮:在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化制作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
时间 浓度 | 0 min | 5 min | 10 min | 15 min | 20 min |
c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5 min内NO2的转化率将_____(填“变大”“变小”或“不变”)。
②下列表述能说明该反应已达到平衡状态的是______(填序号)。
A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是_____(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的![]() 。则:
。则:
①0~10 min内平均反应速率v(Ni)=___g·min-1。
②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的![]() =__。
=__。
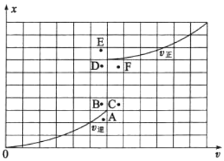
③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为_______、_______(填字母)。