题目内容
【题目】氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。请回答下列问题:
Ⅰ.结晶法制取FeCl2
在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,____,______,固液分离,洗涤,快速干燥制得。
Ⅱ.氯苯还原无水FeC13制取FeC12
无水FeCl3与氯苯反应的化学方程式为:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
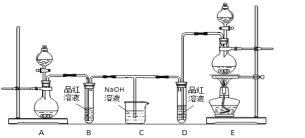
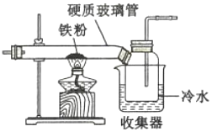
(1)如图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是________。
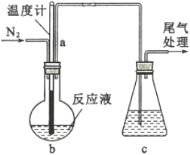
(2)利用如图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下:
C6H5C1(氯苯) | C6H4C12 | FeC13 | FeC12 | |
相对分子质量 | 112.5 | 147 | 162.5 | 127 |
熔点/℃ | -45 | 53 | 306 | 670~674 |
沸点/℃ | 132 | 173 | 315 | 1023 |
将162.5 g无水氯化铁和200 g氯苯加入到圆底烧瓶中,在锥形瓶中加入200 g滴有酚酞的9.5%的NaOH溶液。先通入N2一段时间,再加热,控制温度在132 ℃左右发生反应。实验完成后冷却,分离提纯得到粗产品。
①先通入N2的目的是_______;导管a的作用是______。
②当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过______%。
③实验结束后,回收过量氯苯的操作名称为______。
④指出装置c可能存在的缺点______。
【答案】趁热过滤 (冷却)结晶 FeC13的熔沸点低,防止FeC13冷凝时堵塞导管 除尽装置中的O2和水蒸气,防止FeCl2被氧化、防止发生水解反应 导气,冷凝回流氯苯 95 蒸馏 无防倒吸装置
【解析】
I.在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,趁热过滤、冷却结晶、固液分离,洗涤,快速干燥制得FeCl2;
II.(1)FeCl3熔沸点低,冷凝时易堵塞导管;
(2)在装置b中发生反应:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl,由于Fe2+具有强的还原性,易被空气氧化,先通入N2,排出装置内空气,就可以避免副反应产生的干扰,导气管a同时起导气和冷凝作用,反应产生的HCl被锥形瓶中的NaOH溶液吸收,根据二者反应关系计算产生的HCl的物质的量,进而可知反应的FeCl3的量,结合加入反应物的量计算其转化率。
I.在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,趁热过滤、冷却结晶、固液分离,洗涤,快速干燥制得FeCl2;
II.(1)用干燥的Cl2和铁粉制取无水FeCl3,硬质玻璃管和收集器用大口管连接的原因是FeCl3熔沸点低,防止FeCl3冷凝时堵塞导管;
(2)①先通入N2的目的是排出装置中空气,防止空气中的O2氧化FeCl2变为FeCl3,同时也可以避免反应产生的Fe3+发生水解反应;装置中导管a的作用是导气和冷凝,可以使挥发的未反应的氯苯回流到反应装置;
②n(FeCl3)=![]() =1 mol,n(C6H5C1) =
=1 mol,n(C6H5C1) =![]() =1.78 mol,根据方程式2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知二者反应时的物质的量的比是2:1,n(FeCl3):n(C6H5C1)<2:1,说明氯苯过量,反应根据FeCl3的物质的量计算,n(HCl)=n(NaOH)=
=1.78 mol,根据方程式2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知二者反应时的物质的量的比是2:1,n(FeCl3):n(C6H5C1)<2:1,说明氯苯过量,反应根据FeCl3的物质的量计算,n(HCl)=n(NaOH)=![]() =0.475 mol,根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知氯化铁转化率为:
=0.475 mol,根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知氯化铁转化率为:![]() ×100%=95%;
×100%=95%;
③实验结束后,在装置b中含有过量的氯苯及反应产生的二氯苯,由于氯苯、二氯苯是互溶的沸点不同的液体混合物,所以分离二者混合物,回收其中过量氯苯的操作方法为蒸馏;
④由于HCl气体极易溶于水,并且会与c中NaOH反应,使装置中气体压强过小而引起倒吸现象,因此装置c可能存在的缺点是无防倒吸装置。

【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是__。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留两位小数)。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____。
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
⑤如图是某次滴定时的滴定管中的液面,其读数为__________mL。