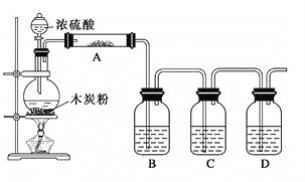
题目内容
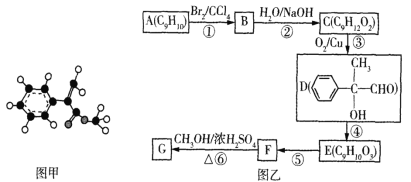
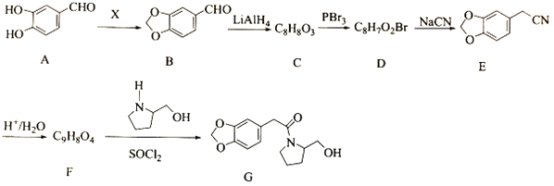
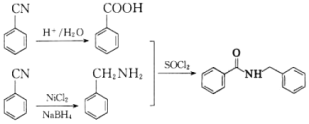
【题目】海南粗榧新碱是从植物中提取的、具有边缘抗肿瘤活性的生物碱,合成该碱的一种常见中间体G的合成线路如图:
已知:①R—COOH+R’—OH ![]()
![]() +H2O
+H2O
②R—CN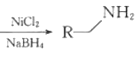
回答下列问题:
(1)X为醛类物质,其名称为_________。
(2)B→C的反应类型为_________。
(3)D→E的反应方程式为_________。
(4)化合物F的结构简式为_________。
(5)有机物Y是A的同分异构体,满足下列条件的Y还有_________种。
①能与FeC13溶液发生显色反应
②1 mo1 Y与足量金属Na反应生成1 mo1 H2
③结构中含“![]() ”
”
其中核磁共振氢谱显示为4组峰,且峰面积比为2:2:1:1的物质为_________(写出其中一种结构简式)。
(6)设计以![]() 为起始原料制备
为起始原料制备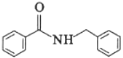 的合成线路__________(无机试剂任选)。
的合成线路__________(无机试剂任选)。
【答案】甲醛 加成(还原)反应 ![]() +NaCN→
+NaCN→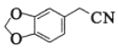 +NaCN
+NaCN ![]() 8
8 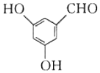 或
或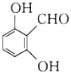 或
或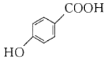
【解析】
X为醛类物质,比较A和B的结构简式可知,X为甲醛,结构简式是HCHO,A与甲醛取代生成B,B发生还原反应生成C为![]() ,C发生取代生成D为
,C发生取代生成D为![]() ,D再发生取代得E,E酸化得F为
,D再发生取代得E,E酸化得F为![]() ,F发生信息①中的取代得到G。
,F发生信息①中的取代得到G。
(6)用![]() 发生成信息②中的反应得到
发生成信息②中的反应得到![]() ,
,![]() 在酸性条件下发生类似E到F的反应得苯甲酸
在酸性条件下发生类似E到F的反应得苯甲酸![]() ,
,![]() 与苯甲酸反应可得
与苯甲酸反应可得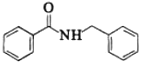 ,据此答题。
,据此答题。
根据上述分析可知:X为HCHO,C为![]() ,D为
,D为![]() ,F为
,F为![]() 。
。
(1)根据上面的分析可知,X为甲醛;
(2)B是![]() ,B在LiAlH4条件下与H2发生加成反应产生C:
,B在LiAlH4条件下与H2发生加成反应产生C:![]() ,与H2的加成反应也叫还原反应,所以B→C的反应类型为加成(还原)反应;
,与H2的加成反应也叫还原反应,所以B→C的反应类型为加成(还原)反应;
(3)D是![]() ,与NaCN发生取代反应产生E:
,与NaCN发生取代反应产生E:![]() ,故D生成E的反应方程式为:
,故D生成E的反应方程式为:![]() +NaCN→
+NaCN→ +NaCN;
+NaCN;
(4)根据上述分析可知,F为![]() ;
;
(5)有机物Y是A的同分异构体,根据条件:①能与FeCl3溶液发生显色反应,说明有酚羟基;②1 mol Y与足量金属Na反应生成1 mol H2,说明Y中有两个羟基(或羧基);③结构中含“![]() ”,则符合条件的Y结构为苯环上连有-OH、-COOH,有邻、间、对三种,或者连有2个-OH和一个-CHO,根据定二移一的方法,有6种结构,所以共有8种(除去本身外);其中核磁共振氢谱显示为4组峰,且峰面积比为2:2:1:1的物质为
”,则符合条件的Y结构为苯环上连有-OH、-COOH,有邻、间、对三种,或者连有2个-OH和一个-CHO,根据定二移一的方法,有6种结构,所以共有8种(除去本身外);其中核磁共振氢谱显示为4组峰,且峰面积比为2:2:1:1的物质为 或
或 或
或 中的任意一种;
中的任意一种;
(6)用![]() 发生信息②中的反应得到
发生信息②中的反应得到![]() ,
,![]() 在酸性条件下发生类似E到F的反应得苯甲酸
在酸性条件下发生类似E到F的反应得苯甲酸![]() ,
,![]() 与苯甲酸反应可得
与苯甲酸反应可得 ,故合成路线为:
,故合成路线为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮的化合物在生产生活中广泛存在。
(1)氯胺(NH2Cl)的电子式为___。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=___。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在电离平衡2NH3(l)![]() NH
NH![]() +NH
+NH![]() ,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
(3)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为___(填“放热”或“吸热”)反应,理由是___;
②下列选项中可以说明容器乙已经达到平衡状态的是___(填序号)
A.容器内压强不变
B.容器内气体的密度不变
C.2υ正(NO)=υ逆(N2)
D.混合气体的平均摩尔质量不变
③乙容器在100min达到平衡状态,则0~100min内用NO的浓度变化表示的平均反应速率υ(NO)=___,平衡常数K(400℃)=___。