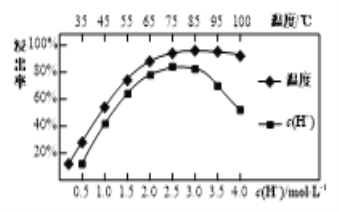
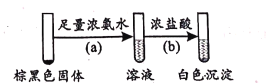
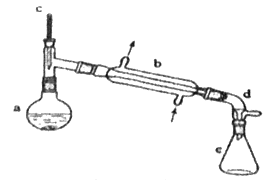
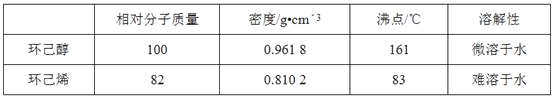
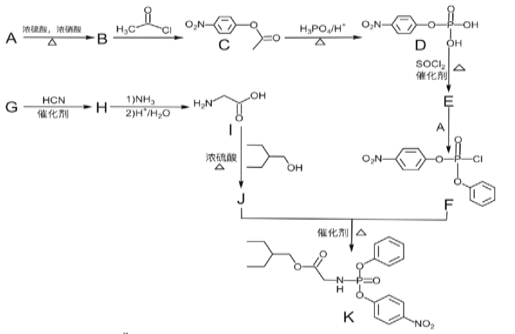
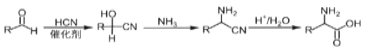
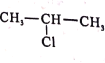
0 198732 198740 198746 198750 198756 198758 198762 198768 198770 198776 198782 198786 198788 198792 198798 198800 198806 198810 198812 198816 198818 198822 198824 198826 198827 198828 198830 198831 198832 198834 198836 198840 198842 198846 198848 198852 198858 198860 198866 198870 198872 198876 198882 198888 198890 198896 198900 198902 198908 198912 198918 198926 203614