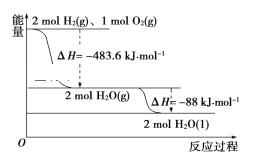
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出_____(填外部因素)的改变对反应速率的影响,其中V1=_____,T1=______;通过实验________可探究出温度变化对化学反应速率的影。
(2)若t1<8,则由此实验可以得出的结论是_________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________。
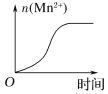
(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________,相应的粒子最可能是(填序号)______。
【题目】已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
0.1mol·Lˉ1KI溶液 | H2O | 0.01mol·Lˉ1X溶液 | 0.1mol·Lˉ1双氧水 | 1mol·Lˉ1稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=___,n=___。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>___,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注)。____
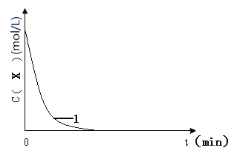
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂___(填“提高”或“降低”)了反应活化能。
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
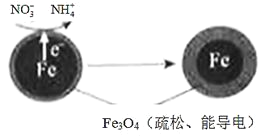
①作负极的物质是_________。
②正极的电极反应式是_________。
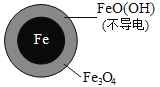
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。