题目内容
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出_____(填外部因素)的改变对反应速率的影响,其中V1=_____,T1=______;通过实验________可探究出温度变化对化学反应速率的影。
(2)若t1<8,则由此实验可以得出的结论是_________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________。
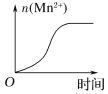
(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________,相应的粒子最可能是(填序号)______。
【答案】浓度 1 293 B、C 其他条件相同时,增大反应物浓度、反应速率增大(其他合理说法也对) 8.3×10-4 mol·L-1·s-1 2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 催化作用 Mn2+
【解析】
(1)实验A、B,从表中数据可知改变的条件是H2C2O4浓度,故通过实验A、B,可探究出浓度的改变对反应速率的影响;溶液的总体积相同,高锰酸钾和草酸的浓度相同,用量也相同,根据实验1可知溶液总体积为6mL,所以V1=1.0mL;其他条件相同,探究浓度对化学反应速率的影响,故温度T1=293;其他条件相同,探究温度对化学反应速率的影响,则B、C符合,故答案为:浓度;1;293;B、C;
(2)若t1<8,则由此实验可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;草酸的物质的量为:0.1molL-1×0.003L=0.0003mol,高锰酸钾的物质的量为:0.02molL-1×0.002L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0003mol:0.00004mol=30:4,显然草酸过量,高锰酸钾完全反应,高锰酸钾的反应速率为: 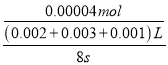 =8.3×10-4 molL-1s-1,故答案为:其他条件相同时,增大反应物浓度,反应速率增大;8.3×10-4 molL-1s-1;
=8.3×10-4 molL-1s-1,故答案为:其他条件相同时,增大反应物浓度,反应速率增大;8.3×10-4 molL-1s-1;
(3)草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水,离子反应方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(4)根据实验过程中n(Mn2+)随时间变化图像可知,反应初期n(Mn2+)减少,反应速率较小,然后突然增大,反应速率突然加快,说明某种粒子对KMnO4与草酸之间的反应起到了催化剂的作用,根据反应方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,该粒子可能为Mn2+,故答案为:催化作用;Mn2+。

【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
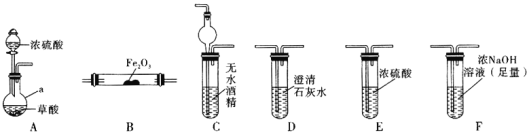
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
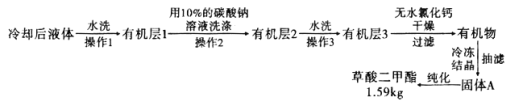
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。