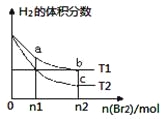
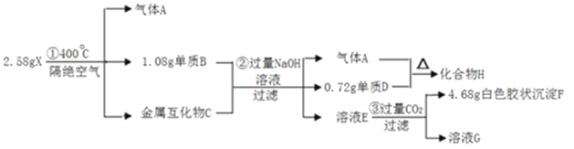
【题目】对于如下反应,其反应过程的能量变化示意图如图:
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g) | K1 | △H1 |
反应② | B(g)+C(g) | K2 | △H2 |
反应③ | A(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2
B. ΔH3=ΔH1 +ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g) N2(g)+3H2 (g),活化能Ea=600kJmol-1,合成氨有关化学键的键能如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
则合成氨反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)的活化能Ea=________。
H2(g)NH3(g)的活化能Ea=________。
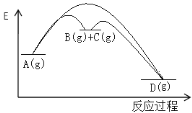
(2)已知2NO+O2=2NO2反应历程分两步
方程式 | 活化能 | 焓变 | |
总反应 | 2NO(g)+O2(g)=2NO2(g) |
| △H<0 |
第一步(快速平衡) | 2NO(g)N2O2(g) | Ea1 | △H1 |
第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:![]() ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数![]() ________(用
________(用![]() 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为![]() ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为![]() ,
,![]() 与
与![]() 是速率常数,则
是速率常数,则![]() ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A.![]() B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
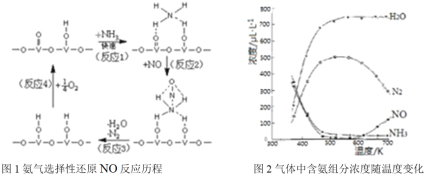
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
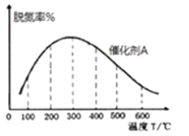
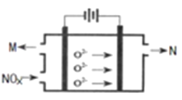
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。
【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________