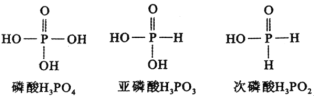
题目内容
【题目】某研究小组按下列路线合成药物氨鲁米特。
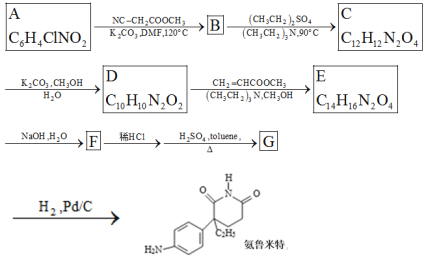
①A到B为取代反应,B的化学式为C10H8N2O4,B到C是乙基化反应。
②C到D的反应包括水解、脱去羧基(CO2 )两步反应。
③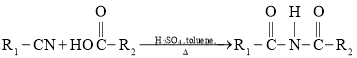
请回答:
(1)化合物A的结构简式________。
(2)下列说法不正确的是________。
A.化合物B能发生加成反应 B.化合物C能发生消去反应 C.化合物G具有碱性且在酸性条件下能水解生成CO2 D.氨鲁米特的分子式是C13H16N2O2
(3)设计化合物A转变为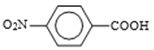 的合成路线(用流程图表示,试剂任选)________。
的合成路线(用流程图表示,试剂任选)________。
(4)写出E→F的化学方程式________。
(5)写出化合物D可能的同分异构体的结构简式________,须同时符合:①1H-NMR谱表明分子中有4种氢原子,IR谱显示仅有苯环无其他环状结构,含氨基-NH2;②该物质能水解,且能发生银镜反应。
【答案】![]() BC
BC 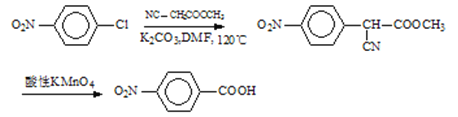
 +NaOH
+NaOH![]()
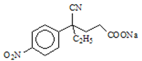 +CH3OH
+CH3OH 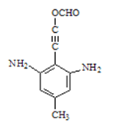

【解析】
A到B为取代反应,B的化学式为C10H8N2O4,结合氨鲁米特结构简式可知A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ,B到C是乙基化反应得到C,C的结构简式为
,B到C是乙基化反应得到C,C的结构简式为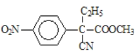 ,C到D的反应包括水解、脱去羧基(CO2)两步反应,则D的结构简式为
,C到D的反应包括水解、脱去羧基(CO2)两步反应,则D的结构简式为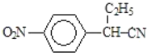 ,D与CH2=CHCOOCH3发生加成反应生成E,E的结构简式为
,D与CH2=CHCOOCH3发生加成反应生成E,E的结构简式为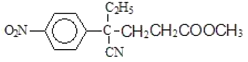 ,E发生水解反应生成钠盐F,F的结构简式为
,E发生水解反应生成钠盐F,F的结构简式为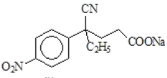 ,F经盐酸酸化生成
,F经盐酸酸化生成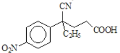 ,
, 在硫酸和toluene条件下分子内发生反应生成G:
在硫酸和toluene条件下分子内发生反应生成G: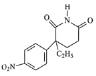 ,G催化加氢得到氨鲁米特;
,G催化加氢得到氨鲁米特;
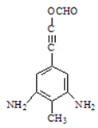
(3)仿照氨鲁米特合成路线中A→B流程,利用取代反应将![]() 转化为
转化为![]() ,再利用酸性高锰酸钾溶液的强氧化性转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,据此分析解答。
,再利用酸性高锰酸钾溶液的强氧化性转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,据此分析解答。
(1)结合产物氨鲁米特的结构简式可知A的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)A.化合物B含有苯环,能与氢气发生加成反应,故A正确;
B.根据化合物C的结构简式可知,B
C.根据化合物G的结构简式可知,G含有亚氨基,具有碱性,在酸性条件下水解生成两个羧基COOH,不能生成CO2,故C错误;
D.根据氨鲁米特的结构简式可知,氨鲁米特的分子式是C13H16N2O2,故D正确;
故答案为:BC;
(3)仿照流程将A转化为B,加入酸性高锰酸钾溶液将其转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,合成路线为: ,
,
故答案为: ;
;
(4)E→F的反应是酯基发生完全水解反应生成钠盐和甲醇过程,方程式为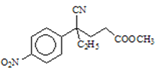 +NaOH
+NaOH![]()
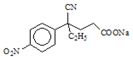 +CH3OH,
+CH3OH,
故答案为: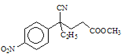 +NaOH
+NaOH![]()
![]() +CH3OH;
+CH3OH;
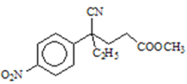
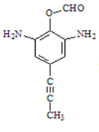
(5)化合物D可能的同分异构体中含有2个氨基NH2,含有酯基COO、并且能发生银镜反应,则化合物D的同分异构体甲酸酯类,并且分子中有4种氢原子,仅有苯环无其他环状结构,结合C四键规律形成可能的同分异构体为


 ,
,
故答案为:


 。
。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________

【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:
已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
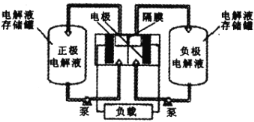
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
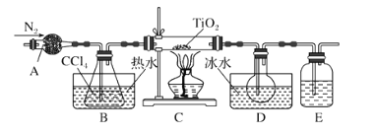
【题目】钛合金在国防、医用器材领域有重要应用,某研究小组利用钛铁矿[主要成分偏钛酸亚铁(FeTiO3),含SiO2、FeO 杂质]制取TiCl4,然后进一步制备金属钛,流程如下∶

已知∶
a.发生的主要反应方程式如下∶
FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O TiOSO4+2H2O
TiOSO4+FeSO4+2H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4
H2TiO3↓+H2SO4
H2TiO3![]() TiO2+H2O
TiO2+H2O
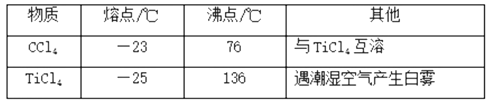
b.部分物质的性质∶
TiCl4 | SiCl4 | FeCl3 | TiO2 | |
沸点/°C | 136.4 | 57.6 | 315 | / |
其它性质 | 极易水解 | / | / | 不溶于水 |
请回答∶
(1)步骤II抽滤时选用了玻璃砂漏斗,请说明选择的理由______。
(2)步骤III为了除去浸取液中的铁元素杂质并回收FeSO47H2O。往浸取液中加入铁粉至溶液中的Fe3+完全转化,然后抽滤,滤液用冰盐水快速冷却至FeSO47H2O结晶析出,再次抽滤并洗涤。下列说法正确的是____。
A.杂质Fe3+可能是在实验过程中氧化生成的
B.再次抽滤获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却有利于形成较大的晶体颗粒
D.再次抽滤后的洗涤应选用蒸馏水进行多次洗涤
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化。操作步骤如下∶取一部分步骤III获得的滤液→(________)→(________)→(________)→(_________)→抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。
①将下列操作按合理顺序填入以上空格。
a.静置沉降后,用倾析法除去上层水;
b.逐滴加入到沸水中并不停搅拌,继续煮沸约10 min;
c.用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀;
d.慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积);
②写出操作c中用热水洗涤沉淀的具体过程_____。
(4)①另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用步骤V的反应原理获得TiCl4.。产品中含有SiCl4、FeCl3等杂质,可通过精馏的方法获得高纯TiCl4,以下说法正确的是______。

A.收集TiCl4时,仪器a中的温度应控制为136.4°C
B. b处温度计的水银球的上沿和支管口的下沿齐平
C.精馏结束时留在圆底烧瓶中的主要成分是FeCl3和Si
D.装置c中的冷凝水应该“下口进、上口出”
E.可以用水浴加热的方法精馏获得TiCl4
②d处装有碱石灰的干燥管,作用是________。