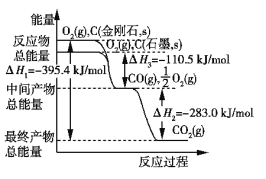
【题目】下列实验中,现象及结论都正确,且二者之间有因果的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | Na2SO3已变质 |
B | 将AlCl3溶液加热蒸干 | 得到白色固体 | 成分为纯净的AlCl3 |
C | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X一定是浓盐酸 |
D | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: |
A.AB.BC.CD.D
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
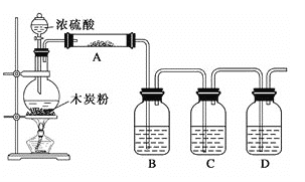
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
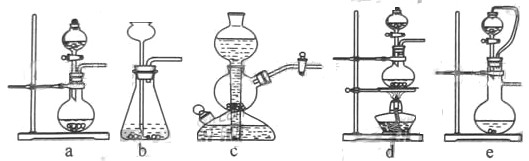
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______g (保留一位小数)。
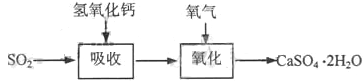
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
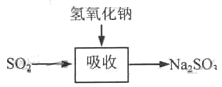
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________。和碱法相比,石灰-石膏法的优点是________________,缺点是________________。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)________________。
【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。