题目内容
【题目】下列实验中,现象及结论都正确,且二者之间有因果的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | Na2SO3已变质 |
B | 将AlCl3溶液加热蒸干 | 得到白色固体 | 成分为纯净的AlCl3 |
C | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X一定是浓盐酸 |
D | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: |
A.AB.BC.CD.D
【答案】D
【解析】
A.由于硝酸根离子在酸性条件下具有强氧化性,能够把亚硫酸根离子氧化为硫酸根离子,干扰了检验结果,应该用氯化钡溶液,故A不符合题意;
B.将AlCl3溶液加热蒸干,加热促进了铝离子的水解,由于HCl易挥发,则最终无法得到纯净的AlCl3,故B不符合题意;
C.生成白烟可以知道X为挥发性酸,则X可能为浓盐酸或浓硝酸等,故C不符合题意;
D.等体积、等浓度的两种盐溶液,NaHCO3溶液红色更深,说明其水解程度更大,所以常温下的水解平衡常数:![]() ,故D符合题意;
,故D符合题意;
故答案为D。

【题目】已知反应![]() 是可逆反应。设计如图装置(
是可逆反应。设计如图装置(![]() 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
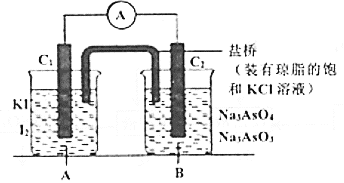
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入![]() 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中![]() 棒上发生的反应为_________;
棒上发生的反应为_________;
②过程中![]() 棒上发生的反应为___________。
棒上发生的反应为___________。
(2)操作②过程中,盐桥中的![]() 移向_________烧杯溶液(填“A”或“B”)。
移向_________烧杯溶液(填“A”或“B”)。
资料:![]() 。向
。向![]() 一定浓度的
一定浓度的![]() 溶液中加入
溶液中加入![]() 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
微粒 |
|
|
|
浓度 |
|
| a |
(3)a=________________。该平衡体系中除了含有![]() 和
和![]() 外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:![]()
反应:![]()
则![]() ______________
______________![]()
(5)已知:25℃时,![]() 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用![]() 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量![]() 仍然是安全的,
仍然是安全的,![]() 不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量
不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量![]() ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的![]() 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中![]() 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的![]() 浓度为
浓度为![]() ,应服用的
,应服用的![]() 溶液的最低浓度为_______
溶液的最低浓度为_______![]() 。
。
【题目】下列根据实验操作所得出的现象和结论均正确的是( )
实验操作 | 实现现象 | 结论 | |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 该溶液中有 |
B | 将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液 | 溶液紫红色褪去 | 碎瓷片的主要作用是使石蜡油受热均匀 |
C | 向 | 有砖红色沉淀生成 | Ksp: |
D | 将变黑的银器放入装满食盐水的铝盆中,二者直接接触 | 银器恢复往日光泽 |
|
A.AB.BC.CD.D