【题目】某化学小组利用硫代硫酸钠进行了相关的实验。
Ⅰ.已知:Na2S2O3+H2 SO4 Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=____,V3=___;
(2)若V4=10.0,V5=6.0,则实验①、③可探究_____对反应速率的影响。
Ⅱ.利用反应:I2+2Na2S2O3 Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用amol/L的碘水滴定,消耗碘水b mL,则:
(3)滴定时,将碘水注入___(填“酸式”或“碱式”)滴定管中,滴定应选择的指示剂是____,滴定终点的现象为________。
(4)对于该滴定实验的有关操作或误差分析正确的是____。
a.滴定前,要用对应装入的溶液润洗锥形瓶和滴定管
b.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
c.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
d.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
(5)样品中硫代硫酸钠纯度的表达式为____。
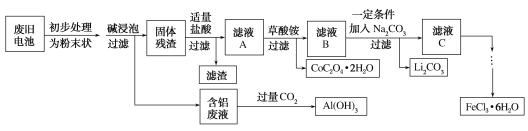
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
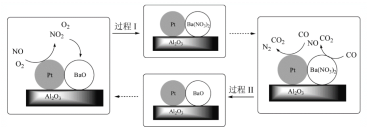
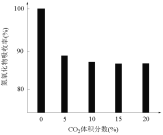
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
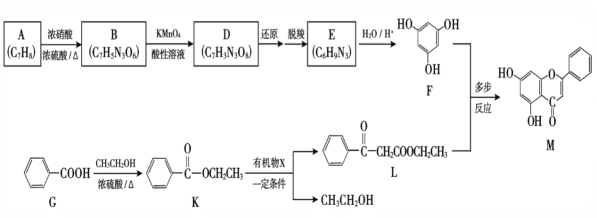
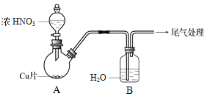
【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。