【题目】草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是___(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20mL0.1molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
② | 20mL0.2molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
①该反应的离子方程式____。
②该实验探究的是___因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是___>__(填实验序号)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为___mol/min,则在2min末c(MnO4-)=___mol/L(假设混合液体积为50mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①____;②____。
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5molL-1盐酸、0.55molL-1NaOH溶液及如图的仪器,尚缺少的实验玻璃用品是____。

(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是 ____。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热△H(平均值) | ||
t1 | t2 | |||
① | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.3℃ | ____ |
② | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ℃-1Kg-1,各物质的密度均为1gcm-3。完成表格。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响。
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
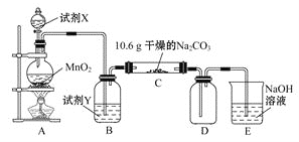
(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
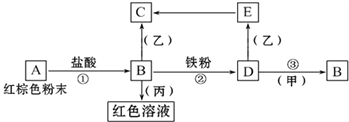
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D