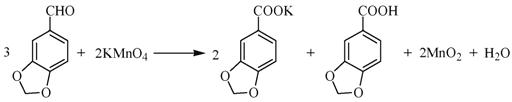
题目内容
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5molL-1盐酸、0.55molL-1NaOH溶液及如图的仪器,尚缺少的实验玻璃用品是____。

(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是 ____。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热△H(平均值) | ||
t1 | t2 | |||
① | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.3℃ | ____ |
② | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ℃-1Kg-1,各物质的密度均为1gcm-3。完成表格。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响。
【答案】量筒 否 Cu易导热,热量散失导致误差大 -56.8kJ/mol 无
【解析】
(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=mC△T计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
(4)KOH代替NaOH都是强碱,符合中和热的概念。
(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少量筒;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55molL-1NaOH和50mL.0.5molL-1HCl质量和为m=100mL×1g/mL=100g,C=4.18J/(g℃),△T=3.4℃,代入公式Q=Cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
(4)KOH代替NaOH都是强碱,符合中和热的概念,所以用KOH代替NaOH,对测定结果无影响。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
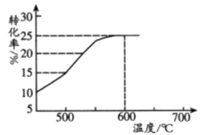
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。