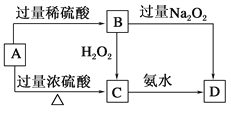
题目内容
【题目】已知常温下![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() 。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,则室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
C.![]() 的
的![]() 和
和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 氨水和
氨水和![]() 溶液等体积混合:
溶液等体积混合:![]()
【答案】BC
【解析】
A.根据SH-的电离程度和水解程度的大小分析;
B.据物料守恒分析;
C.根据电荷守恒分析;
D.由电荷守恒和物料守恒综合分析。
A.![]() 溶液中,存在
溶液中,存在![]() 的水解平衡
的水解平衡![]() ,以及
,以及![]() 的水解平衡
的水解平衡![]() ,由
,由![]() 的电离平衡常数
的电离平衡常数![]() 和
和![]() 的电离平衡常数
的电离平衡常数![]() 可知,溶液以
可知,溶液以![]() 的水解平衡为主,
的水解平衡为主,![]() ,再结合溶液中弱酸根和弱碱根的水解是微弱的特点,溶液中相关微粒浓度大小顺序为
,再结合溶液中弱酸根和弱碱根的水解是微弱的特点,溶液中相关微粒浓度大小顺序为![]() ,故A错误;
,故A错误;
B.据物料守恒![]() ,
,![]() ,
,![]() ,故
,故![]() ,故B正确;
,故B正确;
C.据电荷守恒![]() ,即
,即![]() ,类比A选项可知混合溶液
,类比A选项可知混合溶液![]() ,
,![]() ,又因为
,又因为![]() 水解,混合后
水解,混合后![]() 小于
小于![]() ,所以
,所以![]() ,故C正确;
,故C正确;
D.![]() ,
,![]() 的氨水和
的氨水和![]() 的
的![]() 溶液等体积混合后,得到溶质为
溶液等体积混合后,得到溶质为![]() 氨水和
氨水和![]() 的
的![]() 混合溶液,电荷守恒有
混合溶液,电荷守恒有![]() ①,物料守恒有
①,物料守恒有![]() ②,
②,![]() ③,①
③,①![]() ②
②![]() ③,得
③,得![]() ,故D错误。
,故D错误。
答案选BC。

 阅读快车系列答案
阅读快车系列答案【题目】草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是___(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
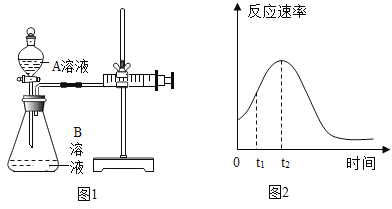
实验序号 | A溶液 | B溶液 |
① | 20mL0.1molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
② | 20mL0.2molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
①该反应的离子方程式____。
②该实验探究的是___因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是___>__(填实验序号)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为___mol/min,则在2min末c(MnO4-)=___mol/L(假设混合液体积为50mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①____;②____。