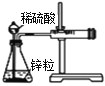
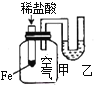
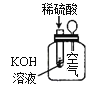
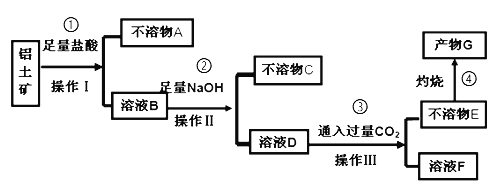
【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
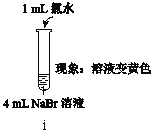
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。