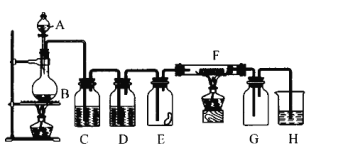
题目内容
【题目】对于相同温度、相同压强下,相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5:4B.质量之比为1:1
C.分子数之比为5:4D.密度之比为4:5
【答案】D
【解析】
既然是相同物质的量的![]() 和
和![]() ,可以假设有1mol
,可以假设有1mol![]() 和1mol
和1mol![]() ,据此来分析就一目了然了。
,据此来分析就一目了然了。
A.根据分析二者都有1mol硫原子,因此硫的质量相同,A项错误;
B.根据![]() ,二者的物质的量n相同,因此只需要比较它们的摩尔质量M就可以知道二者的质量比,
,二者的物质的量n相同,因此只需要比较它们的摩尔质量M就可以知道二者的质量比,![]() 的摩尔质量为64g/mol,
的摩尔质量为64g/mol,![]() 的摩尔质量为80g/mol,因此二者的质量比为4:5,B项错误;
的摩尔质量为80g/mol,因此二者的质量比为4:5,B项错误;
C.根据![]() ,二者的物质的量n相同,所以它们具有相同的分子数,C项错误;
,二者的物质的量n相同,所以它们具有相同的分子数,C项错误;
D.在相同条件下,气体的密度符合![]() ,因此二者的密度就是二者的摩尔质量之比,为4:5,D项正确;
,因此二者的密度就是二者的摩尔质量之比,为4:5,D项正确;
答案选D。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。