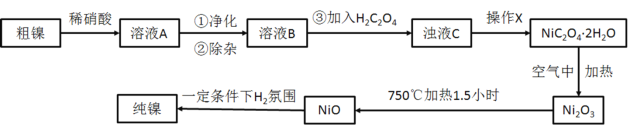
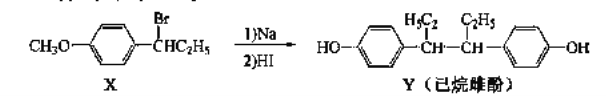
【题目】乙酸乙酯广泛用于药物、燃料、香料等工业,在中学化学实验室里常用如图装置来制备乙酸乙酯。![]() 部分夹持仪器已略去
部分夹持仪器已略去![]()
已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解度 | |
乙醇 | 0.79 | -114.5 | 78.4 | 与水互溶 |
乙酸 | 1.05 | 16.6 | 118.1 | 易溶于水、乙醇 |
乙酸乙酯 | 0.90 | -83.6 | 77.2 | 微溶于水,能溶于乙醇 |
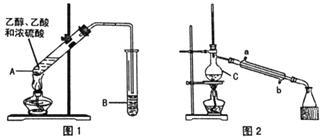
Ⅰ制备粗品(图1)
在A中加入少量碎瓷片,将三种原料依次加入A中,用酒精灯缓慢加热,一段时间后在B中得到乙酸乙酯粗品。
(1)浓硫酸、乙醇、乙酸的加入顺序是___,A中发生反应的化学方程式是___。
(2)A中碎瓷片的作用是___,长导管除了导气外,还具有的作用是___。
(3)B中盛装的液体是___,收集到的乙酸乙酯在___层(填“上”或“下”)。
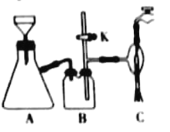
Ⅱ.制备精品(图2)
将B中的液体分液,对乙酸乙酯粗品进行一系列除杂操作后转移到C中,利用图2装置进一步操作即得到乙酸乙酯精品。
(4)C的名称是___。
(5)实验过程中,冷却水从___口进入(填字母);收集产品时,控制的温度应在___左右。