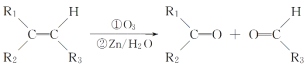
题目内容
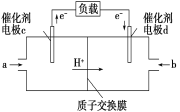
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

【答案】 2Cl-+H2O![]() 2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
【解析】
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+H2O![]() 2OH-+H2
2OH-+H2![]() +Cl2
+Cl2![]() ;
;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,根据装置图分析可以知道精制饱和食盐水从阳极进入,即进口为a。

【题目】现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度(g/mL) | 二者的溶解性 |
甲 | -54.6 | 57.7 | 1.49 | 甲乙互溶 |
乙 | -84.3 | 88.5 | 1.53 |
据此,将甲和乙相互分离的比较好的方法是( )
A.萃取法B.过滤法C.蒸馏法D.分液法