【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
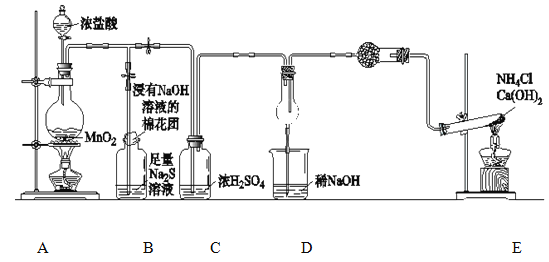
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)

ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
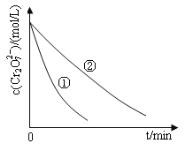
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
【题目】用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液,除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有 ______ 。
(2)滴定:
①盛装0.1000molL-1盐酸标准液应该使用 ______ 式滴定管,滴定时发生反应的离子方程式为: ______ 。
②有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
(3)计算:烧碱样品的纯度是 ______ 。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果 ______ ;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果 ______ 。