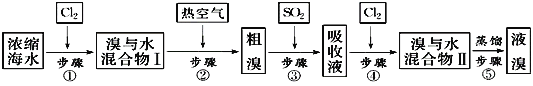
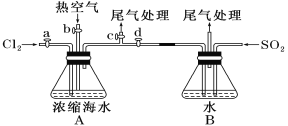
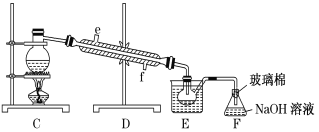
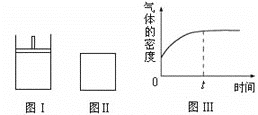
【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一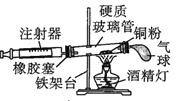 装置二
装置二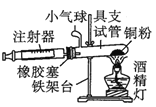
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲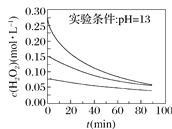 图乙
图乙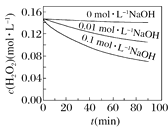
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。
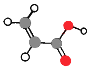
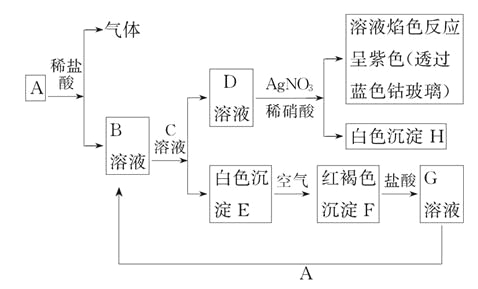
【题目】如表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
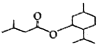
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是___。
(2)B具有的性质是____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(3)由B制备硝基苯的化学方程式____。
(4)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为___;其化学方程式为____。
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼